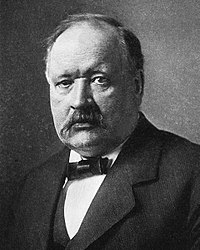Ziyaretçi
Svante Arrhenius
Svante August Arrhenius, (d. 19 Şubat 1859, Uppsala - ö. 2 Ekim 1927, Stokholm), İsveçli kimyacı ve fiziksel kimya biliminin kurucularından.
Uppsala Üniversitesi'nde okuduğu yıllarda fizik ve kimya hocalarından memnun kalmayınca, 1881'de Stokholm'daki İsveç bilimler Akademisi'nin Fizik Enstitüsü'ne geçti. Elektrolitlerin iletkenlikleri üzerine yaptığı çalışmalarını, 150 sayfalık bir tez halinde, doktora derecesi için sundu. Profesörleri tatmin etmeyen ve en düşük notu alan bu çalışmasıyla daha sonra Nobel Kimya Ödülü'nü alacaktı. Tezinin en önemli yanı, saf tuzların veya saf suyun iletken olmadığını, oysa sudaki tuz çözeltilerinin iletken olduklarını açıklamasıydı.
Arrhenius'un açıklamasına göre tuzlar, çözelti oluşturduklarında, yüklü parçacıklara parçalanıyorlardı. Yıllar önce Faraday bunlara iyon adını vermişti. Faraday, iyonların elektroliz prosesi sonucu ortaya çıkacaklarını düşünmesine rağmen, Arrhenius, elektrik akımı olmadan da tuz çözeltilerinin iyon içerebileceğini öneriyordu. Bu nedenle, çözeltilerdeki kimyasal reaksiyonların, iyonlar arasındaki reaksiyonlar olduğunu ileri sürüyordu. Bu teori, zayıf elektrolitler için bugün hala geçerlidir, fakat kuvvetli elektrolitlerin davranışlarını da bu teori kapsamına almak için Peter J. W. Debye ve Erich Hückel'in teoride bazı değişiklikler yapması gerekmiştir.
Sponsorlu Bağlantılar
Uppsala Üniversitesi'nde okuduğu yıllarda fizik ve kimya hocalarından memnun kalmayınca, 1881'de Stokholm'daki İsveç bilimler Akademisi'nin Fizik Enstitüsü'ne geçti. Elektrolitlerin iletkenlikleri üzerine yaptığı çalışmalarını, 150 sayfalık bir tez halinde, doktora derecesi için sundu. Profesörleri tatmin etmeyen ve en düşük notu alan bu çalışmasıyla daha sonra Nobel Kimya Ödülü'nü alacaktı. Tezinin en önemli yanı, saf tuzların veya saf suyun iletken olmadığını, oysa sudaki tuz çözeltilerinin iletken olduklarını açıklamasıydı.
Arrhenius'un açıklamasına göre tuzlar, çözelti oluşturduklarında, yüklü parçacıklara parçalanıyorlardı. Yıllar önce Faraday bunlara iyon adını vermişti. Faraday, iyonların elektroliz prosesi sonucu ortaya çıkacaklarını düşünmesine rağmen, Arrhenius, elektrik akımı olmadan da tuz çözeltilerinin iyon içerebileceğini öneriyordu. Bu nedenle, çözeltilerdeki kimyasal reaksiyonların, iyonlar arasındaki reaksiyonlar olduğunu ileri sürüyordu. Bu teori, zayıf elektrolitler için bugün hala geçerlidir, fakat kuvvetli elektrolitlerin davranışlarını da bu teori kapsamına almak için Peter J. W. Debye ve Erich Hückel'in teoride bazı değişiklikler yapması gerekmiştir.
Son düzenleyen Safi; 6 Aralık 2015 23:17
Biyografi Konusu: Svante Arrhenius nereli hayatı kimdir.

 Svante Arrhenius
Svante Arrhenius