Kök Hücre Nedir
Günümüzde ‘kök hücre’ olarak adlandırdığımız hücreler, esas itibarıyle organizmamızda bulunan normal vücut (somatik) hücrelerimizden bazı önemli farklı özelliklere sahiptir. Bu özelliklerden en önemlileri, yüksek çoğalım kapasitelerine ve vücudumuzun diğer birçok hücre çeşidine farklılaşma yeteneğine sahip olmalarıdır. Canlıda (in vivo) ve laboratuvar koşullarında (in-vitro) uzun dönemler boyunca farklılaşma yeteneklerini kaybetmeksizin çoğalabilme (kendini yenileme;self renewal) ve uygun sinyallere (canlıda genellikle hasar sinyalleri, laboratuvarda ise çeşitli kimyasal uyaranlara) yanıt olarak bulundukları yada farklı doku/organların hücrelerine farklılaşabilme yetenekleri nedeniyle günümüzde hücre esaslı tedaviler başta olmak üzere, deneysel amaçlı gelişimsel biyoloji, ilaç toksisite çalışmaları ve hastalıkların patogenezini anlamada kullanılabilecek önemli bir biyolojik materyal haline gelmiştir.
Kök hücreler yüksek çoğalım potansiyellerini, sahip oldukları yüksek telomeraz enzim aktiviteleri sayesinde devam ettiriken, farklılaşmadan bu işlevi devam ettirmelerini ise, bulundukları mikroçevrelerden (niche;yatak) kaynaklanan bazı sinyal yolaklarının (Wnt, Notch ve Jak/Stat3 gibi) aktivasyonuna bağlı olarak kendini-yenilemeden sorumlu olan transkripsiyon faktörlerinin (oct3, nanog gibi) devam eden ekspresyonlarıyla sürdürürler.
Kök hücreleri nereden elde edebiliriz?
Çoğunlukla bulundukları yerler nerelerdir?
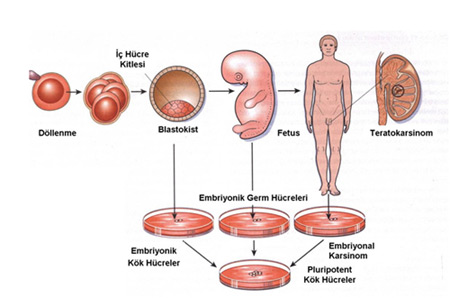
Kök hücreler, elde edildikleri kaynaklar (embriyon, fetüs ve erişkin gibi) ve yukarıda bahsedilen iki önemli özelliklerini (farklılaşma ve çoğalma potensiyellerini) kullanabilmelerinde sahip oldukları güçleri (pluripotent ve multipotent gibi) oranında farklı isimlerle anılırlar. Embriyonik gelişim sürecinin erken dönemlerinde (yaklaşık 5.gün) blastosistin iç hücre kitlesinden elde edilen
embriyonik kök hücreler(EKH),
embriyonik karsinoma hücreleri ve
embriyonik germ hücreleri (EGH; primordiyal germ hücrelerinden elde edilirler) olmak üzere embriyon kökenli kök hücrelerin yanı sıra,
fetal kök hücreler (fetal dönem süresince elde edilirler),
embriyonik olmayan kaynaklardan elde edilen kök hücreler (embriyonik olmayan kök hücreler; dokuya özgün kök hücreler; doğum sonrası dönemdeki kök hücreler),
kanser kök hücreleri ve
partenotlar.
Görüldüğü gibi birçok farklı kaynaktan kök hücre elde etmek olası. Ancak, günümüzde tedavi amaçlı hücresel tedavilerde kullanılmakta ve/veya kullanılması düşünülen ve üzerinde en çalışılan kaynaklar
embriyonik kök hücreler(EKH) ve
hematopoietik kök hücre (HKH) ve
mezenkimal kök hücreleri (MKH) içeren
kemik iliği kök hücreleridir (KİKH) ki bu hücreleri embriyonik olmayan kök hücreler veya
erişkin kök hücreler olarak sınıflandırıyoruz.
Hücrelerin, hücre tedavisindeki tarihçesi
Tedavide canlı hücrelerin kullanılmasının tarihçesi 1960’lı yıllara kadar uzanmaktadır. O yıllarda önceleri kemik iliğimizde bulunan bir grup hücrenin kan sistemini oluşturan hücreleri yaptığının belirlendi, sonraları, kemik iliğindeki bu hücrelerin tüm kan sistemi hücrelerini (kırmızı ve beyaz kan hücreleri gibi) oluşturma yeteneğinden oldukça yararlanıldı. Başta lösemiler olmak üzere birçok genetik kan hastalığının tedavisinde, bu hücrelerin sağlıklı bireylerden hastalara nakliyle (halk arasında “ilik nakli” olarak bilinir) başarılı sonuçlar elde edildi. Kemik iliği nakilleriyle kan yapıcı sistemin yenilenmesi protokolleri uygulanmaya devam ederken, aynı yapıdaki hücrelerin dolaşım sisteminde de varlığı saptandı. Bu kez, araştırmacılar periferik kandaki bu hücreleri daha fazla sayıda ve daha özgün şekilde elde etmenin yollarını aradılar. Sonuçta, “aferez” diye adlandırılan “hücre ayrıştırma” cihazlarıyla bu hücreleri uygun şekilde elde etmek ve nakil tedavilerinde (özellikle otolog) kullanmak mümkün oldu. Bu yöntem, daha az girişimsel teknikleri içermesi ve ekonomik olması gibi nedenlerle tercih edilmektedir.
Sonraki yıllarda gerçekleştirilen in vitro ve in vivo araştırmalar, kemik iliğimizde ve periferik kanımızda yerleşik ve kök hücre olarak tanımlanan bu tip hücrelerin yalnızca bulundukları doku yada organın hücrelerini oluşturmayıp aynı zamanda farklı germ yapraklarından köken alan hücrelere de (sinir, kas, kıkırdak, kemik ve yağ hücresi gibi) farklılaşabildikleri (plastisite yeteneği) gösterildi. Sonraları ise, yine çok eskilerden beri vücudumuzdaki varlığından haberdar olduğumuz fakat sadece bulunduklaru doku yada organların rejenerasyonundan sorumlu hücreler olarak tanımladığımız bazı hücrelerin de benzer yeteneklerde oldukları tespit edildi. Örneğin, derimizin epidermis tabakasının en alt katmanında yerleşik olan ve genç bireylerde her 18 günde derinin yenilenmesini sağlayan bir grup hücrenin, yada gastrointestinal kanalda, özellikle bağırsaklarımızın kripta adını verdiğimiz derin çukurcuklarında yerleşik ve mukozanın yenilenmesini sağlayan hücrelerin de benzer özellikleri tespit edildi. Günümüzde ise, diğer birçok organlarımızın (pankreas, karaciğer, olfaktor mukoza, böbrek vb. gibi) yanında rejenerasyon yetenekleri olmayan yada çok kısıtlı olarak tanımlanan kalp ve merkezi sinir sistemi organlarımızda (beyin ve omurilik gibi) da ‘kök hücre’ veya ‘öncül hücre’ olarak adlandırılan hücreler tespit edilmiştir.
1990’lı yılların başından itibaren de bu kaynaklardan elde edilen kök hücrelerin günümüzde geleneksel tıbbi yöntemlerle tedavisi olası olmayan birçok sağlık sorununun (tip 1 diyabetten parkinson’a, organ yetmezliklerinden ciddi omurilik yaralanmalarına kadar) tedavisinde kullanılabileceği düşüncesi giderek artan oranda kabul gördü. Bu amaçla, otolog kaynaklı KİKH’leri özellikle miyokart infarktüsü sonrası hasarlanmış dokunun yenilenmesi amacıyla ülkemizde olduğu gibi dünyadaki birçok klinikte uygulanmaya başladı. Yapılan çalışmalarda, nakledilen kök hücrelerin yeni damar ve kalp hücrelerinin oluşturabilmelerinin yanı sıra salgıladıkları bazı uyaranların parakrin etki mekanizmalarıyla nakledildikleri organdaki mevcut potansiyeli de harekete geçirdikleri görüldü. Şimdiye kadar, 3000’i aşan sayıda hastada denenen bu yöntem sonucu kazanılan deneyimlerle sanıyorumki kök hücre tabanlı tedavinin ilk rutin uygulaması bu alanda gerçekleşecektir. Bunun yanında, çeşitli kaynaklardan elde edilen kök hücreler, özellikle ciddi omurilik yaralanmaları başta olmak üzere birçok nöro-musküler kas hastalıkları, kemik-kıkırdak doku tamirleri, genetik tabanı olmayan körlük ve sağırlık gibi sağlık sorunları içinde çalışmalar devam etmektedir.
Klinikte Kök Hücre Uygulamalarının mevcut durumu ve geleceği
Kök hücre araştırmalarında son 10-15 yılda gözlenen gelişmeler başta nöro-musküler dejeneratif hastalıklar olmak üzere bu gün için geleneksel medikal yöntemlerle tam olarak tedavisi mümkün olmayan birçok sağlık sorunundan muzdarip insanlar için umut olmuştur. Ancak, bu yaklaşımların klinikte tatbik edilmesinden önce, üstesinden gelinmesi gereken önemli sorunlar vardır. Öncelikle, bir kimya ya da farmakoloji laboratuarında keşfedilen bir kimyasal ilacın klinikte rutin uygulanabilir bir ilaç olabilmesi için yaklaşık 12-15 yıl kadar bir zamana gereksinim vardır. Faz I, II ve III çalışmaları olarak adlandırılan aşamaları geçtikten sonra ancak klinikte rutin uygulanabilir hale gelebilmektedir. Hatta, bazen rutin uygulamalar sırasında ortaya çıkabilecek bir takım olumsuz yan etkilerin gözlenmesiyle, tekrar tekrar incelemeye alınabilmektedir. Kök hücrelerin, tıbbın birçok alanında klinikte rutin uygulanabilir bir medikal unsur olabilmesi için ise, durum biraz daha karışıktır. Öncelikle, insanlara uygulamada kullanılan materyal biyolojik materyaldir, yani canlı hücrelerden oluşmaktadır. Dolayısıyla, bu hücrelerin nakledildikleri insan organizmasından nasıl davranacağının çok iyi bilinmesi gerekmektedir. Örneğin, yapılan deneysel çalışmalar ve klinik denemelerde EKH’lerinin teratom oluşturma riski vardır. Bunun yanında, en iyi sonucun hangi formdaki hücreyle elde edileceği sorusunun kesin yanıtı verilmelidir. Kök hücre formatında mı? Yoksa farklılaşmış hücreler olarak mı? Bu hücreler hangi yolla verilmelidir? Damar yoluyla mı? Yoksa doğrudan hasarlı organa mı? Şayet, nakledilen hücreler istediğimiz özgün hücreler yerine başka hücreleri oluşturmaya başlarsa hangi işlemlere başvurulacak? İşler yolunda gitmezse uyguladığımız tedavi protokolünü nasıl sonlandıracağız? Şayet, kullanılan hücreler başka bireylerden elde ediliyorsa, bu kez nakledilen hücrelerin bağışık reddini engellemeye yönelik toksik olmayan stratejilerin geliştirilmesi gerekmektedir. Yine, hastalığın kökeninde genetik bir bozukluk söz konusuysa böyle bir kişinin kök hücrelerinin izole edilerek, aynı kişiye nakledilmesiyle sorun çözülebilecekmidir? Erişkin kök hücrelerinin çoğalabilme yetenekleri embriyonik kök hücrelere oranla daha sınırlıdır. Yaş ilerledikçe çoğalma hızları azalır. Erişkin kök hücreleri güneş ışığına, toksinlere ve yaşam süresi boyunca DNA replikasyonunda meydana gelebilecek hatalar dolayısıyla daha fazla DNA hatası içerebileceklerine ilişkin bulgular mevcuttur. Erişkin kök hücrelerinin elde edilmesinde güçlükler söz konusudur. Örneğin, sinir kök hücresi elde etmek için bir insanın beynine müdahale etmenizin birçok güçlüğü vardır.
Bilim dünyası, tüm bu soru ya da sorunların yanıtlarını aramakla meşgul. Birçok bilim otoritesinin belirttiği gibi biraz daha zamana gereksinim var. Ancak, günümüzde gerek laboratuarlarda gerekse klinikteki başarılı denemeler, teknolojideki gelişmeler ve kök hücre araştırmalarına verilen destekler (örneğin, ABD California eyaleti bu tür araştırmalar için üç milyar dolarlık bir fon ayırmıştır) geleceğe umutla bakmamıza neden olmaktadır.
Kök Hücre Çalışmalarının Etik ve Hukuksal Boyutu
Bilindiği gibi günümüzde kök hücreler birçok farklı kaynaktan elde edilebilmektedir. Bunlar arasında, yüksek çoğalım ve her türlü hücreye dönüşebilme yeteneği kriter olarak alındığında en önemli kaynak Embriyonik Kök Hücrelerdir (EKH). Kök hücrelerin bu çeşidi 5-5,5 günlük blastosist aşamasına gelmiş insan embriyonlarının iç hücre kitlelerinden elde edilmektedir. Bu nedenle de dini ve etik yönden bir hayli tartışma konusu olmuşlardır. ‘Embriyon ne zaman insan olur’ sorusuyla başlayan bu tartışma birçok açıdan geçmişten günümüze gelmiş ve devam etmektedir. Sürecin önemli aşamalarından biri olan 2001 yılındaki ABD Başkanı Bush’un EKH çalışmalarını önemli oranda kısıtlayan genelgesinin etkileri günümüzde ülkemizde de sürmektedir. 2005 yılında Sağlık Bakanlığının yayımlandığı bir genelgeyle ülkemizde insan EKH çalışmaları durdurulmuştur. ABD’deki bu konuda süregelen kısıtlamalar geçtiğimiz dönem başkanlık seçimlerin önemli tartışma konularından birini oluşturmuş ve öyle görünüyorki önümüzdeki dönemdeki başkanlık seçimlerinin ana temalarından birini oluşturacaktır. Ki bunun ilk belirtileri geçtiğimiz günlerde ABD Temsilciler Meclisi ve Senatosunca hem Demokratlar (ki hemen tamamınca) hem de bir kısım Cumhuriyetci’lerin oylarıyla ‘Kök Hücre Çalışmalarındaki Kısıtlamaların Kaldırılması’ yönünde aldığı kararla da ortaya çıkmıştır. Ancak, ABD Başkanı görev yaptığı sürece ilk kez veto hakkını kullanmış ve bu karar hükümsüz kalmıştır. Sonuç olarak, insan EKH araştırmalarının önündeki bu tür engellemelere rağmen bilim insanları kök araştırmalarına devam etmenin çeşitli yollarını aramaktadır. Dişi yumurta hücresi oosit’in partenogenetik induksiyonu ile elde edilen embriyonlardan EKH’lerin üretilmesi, implantasyona uygun olmayan kötü kalitedeki embriyonların bu amaçla kullanılması, sekiz hücreli morula aşamasına gelmiş embriyonlardan günümüzde birçok IVF laboratuarında kullanılan preimplantasyon genetik tanı (PGT) yöntemine benzer olarak bir blastomerin izole edilmesi ve bu hücreden yeni EKH dizisi elde edilmesi ve son olarak ‘değişmiş somatik hücre transferi’ (altered somatic cell nucleus transfer) denilen teknikle klasik anlamda klonlamada kullanılan tekniğe benzer olarak fakat bu kez verici hücrenin genetik yapısını değiştirerek (cdx2 genini silerek ki bu genin yokluğunda embriyonda trofoektoderm oluşmamaktadır ve dolayısıyla gelişecek embriyonun plasenta ve benzeri yapıları gelişemeyecek ve implante olamayacaktır) elde edilen embriyonların kullanılması şimdiye dek denenen yöntemlerdir. Ayrıca, EKH’lere alternatif olarak erişkin kök hücrelerin kullanılması ve var olan somatik hücre yada somatik (erişkin) kök hücrenin yeniden programlanarak (dedifferensiasyon-geri yönde farklılaşma) daha ilkel kök hücreler yani pluripotent karekterli kök hücreler elde edilmesine yönelik çabalar devam etmektedir.
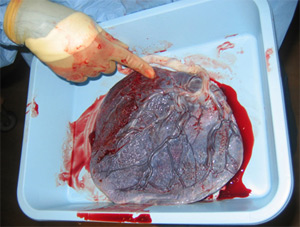
Kordon Kanı Nedir
Son yıllarda, kan kök hücre kaynağı olarak göbek kordonundan elde edilen kan da kullanılmaktadır. 1980'li yılların başlarında bilim adamlarının yeni doğan bebeklerin kordon kanında da kemik iliğindekine benzer kök hücrelerinin bulunduğunu farketmeleri ile birlikte kordon kanından elde edilen bu hücrelerin belirli hastalıkların tedavisinde kullanılabileceği fikri ortaya çıktı. Göbek kordonu kanının, zengin bir kaynak olduğunun anlaşılması üzere 1988'den beri tedavi amaçlı kullanılmaya başlandı. 1988 yılında Fankoni aplastik anemi hastalığı bulunan bir çocuk ilk kez kordon kanı ile tedavi edildi.
Elde edilen kordon kanının belirli koşullar altında toplanıp dondurularak saklanabileceği ve daha sonra gerek duyulduğunda çözülerek kullanılabileceğini fark eden Dr. David Harris 1992 yılında oğlunun kordon kanını kendi laboratuvarında dondurarak sakladı. Daha sonra bu uygulamayı halka açması ile 1994 yılında dünyadaki ilk göbek kordonu kanı bankası ABD'de kurulmuş oldu. Takip eden yıllar içinde dünya üzerinde pek çok göbek kordonu kanı bankası kuruldu.
Kordon Kanı Nedir
Son yıllarda, kan kök hücre kaynağı olarak göbek kordonundan elde edilen kan da kullanılmaktadır. 1980'li yılların başlarında bilim adamlarının yeni doğan bebeklerin kordon kanında da kemik iliğindekine benzer kök hücrelerinin bulunduğunu farketmeleri ile birlikte kordon kanından elde edilen bu hücrelerin belirli hastalıkların tedavisinde kullanılabileceği fikri ortaya çıktı. Göbek kordonu kanının, zengin bir kaynak olduğunun anlaşılması üzere 1988'den beri tedavi amaçlı kullanılmaya başlandı. 1988 yılında Fankoni aplastik anemi hastalığı bulunan bir çocuk ilk kez kordon kanı ile tedavi edildi.
Elde edilen kordon kanının belirli koşullar altında toplanıp dondurularak saklanabileceği ve daha sonra gerek duyulduğunda çözülerek kullanılabileceğini fark eden Dr. David Harris 1992 yılında oğlunun kordon kanını kendi laboratuvarında dondurarak sakladı. Daha sonra bu uygulamayı halka açması ile 1994 yılında dünyadaki ilk göbek kordonu kanı bankası ABD'de kurulmuş oldu. Takip eden yıllar içinde dünya üzerinde pek çok göbek kordonu kanı bankası kuruldu.
Kordon Kanının Önemi
Kordon kanındaki kök hücreler, elde edilebilecek en genç kök hücrelerdir. Bu hücreler saklanmak için dondurulduklarında yaşlanma ve yıpranma süreçleri de durdurulmuş olur. Kordon kanı kök hücreleri, kemik iliği kök hücrelerine göre daha genç ve potent olması nedeniyle daha üstün çoğalma ve farklılaşma yeteneğine sahiptir.
Lösemi gibi bazı hastalıklarda kemik iliği nakli kaçınılmaz bir tedavi seçeneği olarak hastaların karşısına çıkabilir. Bu durumda hastanın doku grubu uyumlu olan sağlıklı bir vericiden alınan kök hücreleri hasta kişiye verilerek sağlıklı kan hücrelerinin yeniden üretilmesi amaçlanır. Ancak hastanın kendi kardeşleri arasında doku gurubu 6 da 6 uyumlu bir verici bulma olasılığı %25'ler civarındadır. Oysa kordon kanı için doku uyumunda bu oran 6 da 4’e hatta 6 da 3’ e kadar kabul edilebilir sınırlar içinde olduğundan kardeşlerin birbirine uyma olasılığı %50’lere ulaşabilmektedir . İşte bu özellik kordon kanının, kök hücreye ihtiyaç duyan hastalar için kolay bulunan bir kök hücre kaynağı olarak ortaya çıkmasına neden olmuştur. Ayrıca kişi kendisi için saklanmış kordon kanını ileride gelişebilecek bir hastalığın tedavisinde kök hücre kaynağı olarak kullanabilmektedir.
Saklanan kordon kanındaki kök hücreler, gerekli olduğu durumda hemen kullanılabilecek haldedir. Kordon kanı kök hücrelerini
GMP standartlarında laboratuar ortamında çoğaltarak (
ex vivo ekspansiyon)) erişkin hastalarda da tedavide kullanmak mümkün hale gelmiştir. Bu durum, hastalıkların ilerlemesini önleyebilmek için kısa sürede tedavinin zorunlu olduğu durumlarda ayrıca önem kazanır.
Son 5 yıldır yapılan araştırmalarda ise kordon kanı içindeki bu kök hücrelerin sadece kan ve kemik iliğini oluşturma yeteneğine sahip olmadığı aynı zamanda diğer doku hücrelerine de dönüşebilme yeteneğinde olduğu saptanmıştır. Bu da insanlık için organ yenilenmesi çalışmalarında yepyeni umutları gündeme getirmiştir.
Tüm bunlar kordon kanının değerli bir kök hücre kaynağı olduğu sonucunu doğurmaktadır.
Kordon kanının alınması nasıl gerçekleştirilir?
Kordon kanı bebek doğar doğmaz ilk 10 dakika içinde, göbek bağının plasenta tarafında kalan bölümünden alınır. Bu kan, plasenta ile birlikte atıldığından, toplanması normal doğum prosedürünü ve bebeği herhangi bir şekilde etkilememektedir. Genelde toplama işlemi doğum esnasında doğumu yaptıran hekim tarafından yapılırsa da, daha doğru olan kordon kanı almakta eğitim görmüş deneyimli personelin kanı toplamasıdır. Böylece hem ürün kaybı en aza indirilebilmekte hem de toplanacak ürünün steril ve sağlıklı izolasyonu garanti edilebilmektedir. Kordon kanı toplanması hem normal yolla hem de sezeryan doğumlarda uygulanabilen bir işlemdir.
Sadece birkaç dakika süren kordon kanının toplanması işlemi; basit, tehlikesiz ve acı vermeyen bir uygulamadır. Bu işlem sırasında yaklaşık 60-120 mililitre kordon kanı pıhtılaşmayı önleyici madde içeren kan torbası içine toplanır. Araştırmalar fazla miktarda kök hücre içeren örneklerin, nakil sonrası daha başarılı sonuç verdiğini kanıtlamıştır.
Toplanan kan, 36 saat içinde kordon kanı bankası laboratuvarına gönderilerek, özel yöntemler ile dondurulur ve sıvı azot içinde saklanır. Dondurulan hücreler gerek duyulduğunda çözülerek tedavide kullanılabilir.
Gen Tedavisi ve Kök Hücreler
Halen ABD’de yapılan hücre programlanması ve gen tedavisi çalışmalarının üçte birinde, kök hücreler kullanılmaktadır. Vücut dışında programlanan kök hücrelerde birçok hastalığı tedavi etmek mümkündür. Kök hücrelerin en büyük avantajı, kendilerini sürekli olarak yenileyebilmeleridir. Böylece, programlanmış olan diğer hücreleri defalarca hastaya verilmesi yerine kök hücrelerinin bir kez verilmesi mümkün olmaktadır. Örneğin Şekil 1’de da görüldüğü gibi, hastanın kan kök hücrelerine virüsler veya mikrokeseciklerle istenen gen yerleştirilir. Genetik yapısı değiştirilen kök hücreler kültürde çoğaltılır ve belli bir sayıya ulaştıktan sonra vücuda geri verilir. Programlanan kan kök hücreleri vücuda verildiğinde başta kemik iliği, karaciğer, dalak ve lenf düğümleri olmak üzere çeşitli organlara yerleşir ve işlevini görür.
Gen tedavisiyle kök hücrelerini maniple etmek her zaman mümkün görünüyor. Bu yöntemin kullanılması yoluyla özgün bir hücre tipine farklılaşmayı yönlendiren veya istenilen bir protein ürününü ekprese eden genler embriyonik kök hücre serilerine verilebilmektedir (Şek.2).
Nisan (2003) ayında Nature Medicine’de yayınlanan bir makaleye göre araştırmacılar, diyabetik farelerin hepatosit kök hücrelerine neuro – d ve betacellulin genlerini vererek, onların insülin salgılayan hücrelere dönüşümünü teşvik ettiler ve normoglisemiyi sağladılar. Şimdi bunu insanlarda denemeyi düşünüyorlar. Eğer bu tür teknikler insan embriyonik kök hücrelerinin kullanılması yoluyla geliştirilebilirse, gen tedavisi için daha iyi yöntemlerin bulunması mümkün olabilecektir.
Yakın zamanda gerçekleştirilen birbaşka çalışmada ise, beta-hücre farklılaşması için önemli bir transkripsiyon faktörü olan Pax4 geni ile transfekte EKH’lerden elde edilen hücrelerin farelere transplantasyonu sonrası kan glikoz düzeylerinin normalleştiği gözlendi.

 Kök Hücre Nedir? Kök Hücre Teknolojileri Hakkında
Kök Hücre Nedir? Kök Hücre Teknolojileri Hakkında