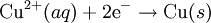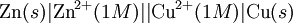Ziyaretçi
Elektrokimya
MsXLabs.org & Vikipedi, özgür ansiklopedi
Elektrokimya, kimya biliminin bir dalı olup elektronik bir iletken (metal, grafit, veya yarı iletken) ile iyonik bir iletken (elektrolit) arayüzeyinde gerçekleşen reaksiyonları inceler.
Eğer harici bir voltaj uygulanarak bir kimyasal reaksiyon meydana getiriliyor veya, pilde olduğu gibi, bir kimyasal reaksiyon bir voltaja neden oluyorsa bu bir "elektrokimyasal reaksiyon"dur. Bir molekülden diğerine doğrudan yük taşınımı, elektrokimyanın konusu değildir.
Tarihçe
16. ile 18. yüzyıllar arasındaki gelişmeler
16. yüzyıl, elektriğin yavaş yavaş anlaşılmaya başlandığı yüzyıl olmuştur. Bu yüzyılda, İngiliz bilimadamı William Gilbert 17 yıl boyunca ağırlıklı olarak manyetizma ve elektrik üzerine çalışmış ve bu çalışmaları ona manyetizmanın babası unvanını kazandırmıştır. Gilbert, mıknatısların üretimi ve güçlendirilmesi üzerine farklı metotlar keşfetmiştir.
1663'te Alman fizikçi Otto von Guericke, sürtünme ile çalışarak statik elektrik üreten ilk elektrik jeneratörünü geliştirdi.
1700'lerin ortalarında, Fransız kimyacı Charles François de Cisternay du Fay, aynı yüklerin birbirini ittiği, zıt yüklerin birbirini çektiği iki farklı tür statik elektriğin varlığını keşfetti.
Charles-Augustin de Coulomb, 1781'de elektrostatik çekim kanununu geliştirdi. İtalyan doktor ve anatomi uzmanı Luigi Galvani, 1791'de yazdığı eserinde ("De Viribus Electricitatis in Motu Musculari Commentarius" (Latince: Elektriğin kas hareketlerine etkisi üzerine yorumlar)) kimyasal reaksiyonlar ve elektrik arasında bir köprü kurarak elektrokimyanın doğumunu belirledi.
19. yüzyıl
1800'de, İngiliz kimyacılar William Nicholson ve Johann Ritter, suyu elektroliz yoluyla hidrojen ve oksijene ayrıştırmayı başardılar. Kısa süre sonra Ritter, elektro-kaplama prosesini keşfetti ve elektrolitik bir proseste, kaplanan metal ile üretilen oksijen miktarının elektrotlar arasındaki mesafeye bağlı olduğunu gözlemledi.
1810 yılında, William Hyde Wollaston, galvanik pili daha da geliştirdi. Humphry Davy'nin elektroliz üzerine yaptığı çalışmalar, basit elektrolitik hücrelerde üretilen elektriğin, zıt yüklü maddeler arasındaki kimyasal reaksiyonun ve kimyasal bağlanmanın bir sonucu olduğunu gösterdi.
1820'de, Hans Christian Ørsted'in elektrik akımının manyetik etkisini keşfi, büyük çığır açan bir gelişmeydi. André-Marie Ampère, Ørsted'in deneylerini tekrarladı ve matematiksel olarak formüle etti.
1821'de, Estonyalı-Alman fizikçi Thomas Johann Seebeck iki farklı metalin ek yerlerinde ısı farkı olduğunda elektriksel bir potansiyel oluştuğunu gösterdi.
Alman bilimadamı Georg Ohm, 1827'de yayımladığı ünlü kitabı "Die galvanische Kette, mathematisch bearbeitet" (Galvanik devrenin matematiksel incelenmesi)'nde, günümüzde kendi adıyla bilinen Ohm kanunu'nu açıkladı.
Michael Faraday, gerçekleştirdiği elektrokimya deneylerinin sonuçlarını 1832 yılında ünlü iki kanunu ile açıkladı. 1836'da John Daniell elektrik üretirken hidrojen çıkarmayan hücresini keşfetti.
William Grove ilk yakıt hücresini 1839'da üretti. 1846'da Wilhelm Weber elektro-dinamometre'yi icat etti. 1866'da Georges Leclanché günümüzde tüm dünyada yaygın olarak kullanılan çinko-karbon pili'nin ilk öncüsü kabul edilebilecek hücrenin patentini aldı.
1886'da Paul Héroult ve Charles M. Hall, Michael Faraday'ın tanımladığı prensiplerden yararlanarak aluminyum eldesine yönelik başarılı bir metot geliştirdiler.
1894'te Friedrich Ostwald, organik asitlerin elektriksel iletkenliği ve elektrolitik parçalanması üzerine yaptığı çalışmalarını tamamladı.
1898'de Fritz Haber, elektrolitik proseslerde katot potansiyeli sabit tutulduğunda belirli redüksiyon ürünlerinin meydana gelebileceğini gösterdi.
20. yüzyıldaki ve yeni gelişmeler
MsXLabs.org & Vikipedi, özgür ansiklopedi
Sponsorlu Bağlantılar
Elektrokimya, kimya biliminin bir dalı olup elektronik bir iletken (metal, grafit, veya yarı iletken) ile iyonik bir iletken (elektrolit) arayüzeyinde gerçekleşen reaksiyonları inceler.
Eğer harici bir voltaj uygulanarak bir kimyasal reaksiyon meydana getiriliyor veya, pilde olduğu gibi, bir kimyasal reaksiyon bir voltaja neden oluyorsa bu bir "elektrokimyasal reaksiyon"dur. Bir molekülden diğerine doğrudan yük taşınımı, elektrokimyanın konusu değildir.
Tarihçe
16. ile 18. yüzyıllar arasındaki gelişmeler
16. yüzyıl, elektriğin yavaş yavaş anlaşılmaya başlandığı yüzyıl olmuştur. Bu yüzyılda, İngiliz bilimadamı William Gilbert 17 yıl boyunca ağırlıklı olarak manyetizma ve elektrik üzerine çalışmış ve bu çalışmaları ona manyetizmanın babası unvanını kazandırmıştır. Gilbert, mıknatısların üretimi ve güçlendirilmesi üzerine farklı metotlar keşfetmiştir.
1663'te Alman fizikçi Otto von Guericke, sürtünme ile çalışarak statik elektrik üreten ilk elektrik jeneratörünü geliştirdi.
1700'lerin ortalarında, Fransız kimyacı Charles François de Cisternay du Fay, aynı yüklerin birbirini ittiği, zıt yüklerin birbirini çektiği iki farklı tür statik elektriğin varlığını keşfetti.
Charles-Augustin de Coulomb, 1781'de elektrostatik çekim kanununu geliştirdi. İtalyan doktor ve anatomi uzmanı Luigi Galvani, 1791'de yazdığı eserinde ("De Viribus Electricitatis in Motu Musculari Commentarius" (Latince: Elektriğin kas hareketlerine etkisi üzerine yorumlar)) kimyasal reaksiyonlar ve elektrik arasında bir köprü kurarak elektrokimyanın doğumunu belirledi.
19. yüzyıl
1800'de, İngiliz kimyacılar William Nicholson ve Johann Ritter, suyu elektroliz yoluyla hidrojen ve oksijene ayrıştırmayı başardılar. Kısa süre sonra Ritter, elektro-kaplama prosesini keşfetti ve elektrolitik bir proseste, kaplanan metal ile üretilen oksijen miktarının elektrotlar arasındaki mesafeye bağlı olduğunu gözlemledi.
1810 yılında, William Hyde Wollaston, galvanik pili daha da geliştirdi. Humphry Davy'nin elektroliz üzerine yaptığı çalışmalar, basit elektrolitik hücrelerde üretilen elektriğin, zıt yüklü maddeler arasındaki kimyasal reaksiyonun ve kimyasal bağlanmanın bir sonucu olduğunu gösterdi.
1820'de, Hans Christian Ørsted'in elektrik akımının manyetik etkisini keşfi, büyük çığır açan bir gelişmeydi. André-Marie Ampère, Ørsted'in deneylerini tekrarladı ve matematiksel olarak formüle etti.
1821'de, Estonyalı-Alman fizikçi Thomas Johann Seebeck iki farklı metalin ek yerlerinde ısı farkı olduğunda elektriksel bir potansiyel oluştuğunu gösterdi.
Alman bilimadamı Georg Ohm, 1827'de yayımladığı ünlü kitabı "Die galvanische Kette, mathematisch bearbeitet" (Galvanik devrenin matematiksel incelenmesi)'nde, günümüzde kendi adıyla bilinen Ohm kanunu'nu açıkladı.
Michael Faraday, gerçekleştirdiği elektrokimya deneylerinin sonuçlarını 1832 yılında ünlü iki kanunu ile açıkladı. 1836'da John Daniell elektrik üretirken hidrojen çıkarmayan hücresini keşfetti.
William Grove ilk yakıt hücresini 1839'da üretti. 1846'da Wilhelm Weber elektro-dinamometre'yi icat etti. 1866'da Georges Leclanché günümüzde tüm dünyada yaygın olarak kullanılan çinko-karbon pili'nin ilk öncüsü kabul edilebilecek hücrenin patentini aldı.
Svante August Arrhenius'un, 1884'te yayımladığı Recherches sur la conductibilité galvanique des électrolytes (Elektrolitlerin galvanik iletkenliği üzerine araştırmalar) adlı tezinin sonuçlarına göre, elektrolitler su içinde çözündüklerinde, değişen derecelerde ve elektriksel olarak zıt yüklü iyonlara ayrışıyorlardı.
İsveçli kimyacı Svante Arrhenius (1880'li yıllar)
1886'da Paul Héroult ve Charles M. Hall, Michael Faraday'ın tanımladığı prensiplerden yararlanarak aluminyum eldesine yönelik başarılı bir metot geliştirdiler.
1894'te Friedrich Ostwald, organik asitlerin elektriksel iletkenliği ve elektrolitik parçalanması üzerine yaptığı çalışmalarını tamamladı.
Walther Hermann Nernst 1888'de volta hücresinin elektromotor kuvvetinin teorisini geliştirdi. Ertesi yıl, üretilen akımın karakteristiklerinden yararlanarak, akımı üreten kimyasal reaksiyonun serbest enerjisinin nasıl hesaplanacağını açıklayan ve günümüzde Nernst denklemi olarak bilinen eşitliği oluşturdu.
Alman bilimadamı Walther Nernst (1910'lu yıllar)
1898'de Fritz Haber, elektrolitik proseslerde katot potansiyeli sabit tutulduğunda belirli redüksiyon ürünlerinin meydana gelebileceğini gösterdi.
20. yüzyıldaki ve yeni gelişmeler
- 1902'de The Electrochemical Society kuruldu.
- 1909'da Robert Andrews Millikan, tek bir elektronun elektrik yükünü belirleme deneylerine başladı.
- 1923'de Johannes Nicolaus Brønsted ve Thomas Martin Lowry, asit ve bazların nasıl davrandığına ilişkin teorilerini yayımladılar.
- Arne Tiselius, 1937'de ilk gelişmiş elektroforetik cihazı yaptı ve protein elektroforezi ile ilgili çalışmalarından ötürü 1948 yılında Nobel Ödülü'ne layık görüldü.
- 1949'da International Society of Electrochemistry kuruldu.
- 1960 ve 1970'li yıllarda Revaz Dogonadze ve öğrencileri kuantum elektrokimyasını geliştirdiler.

 Elektrokimya
Elektrokimya