Ziyaretçi
Belirli bir oksidasyon veya redüksiyon yarı-reaksiyonu için “redüksiyon potansiyeli” adıyla bilinen rakamsal bir değer mevcuttur. Sembolü E° olup standart termodinamik şartlar altında (tüm gazların 25°C, 1 atm de ve tüm sulu çözeltilerin 1M konsantrasyonda olduğu) anlamına gelir ve reaksiyonun yazıldığı yönde gerçekleşme olasılığının büyüklüğünü gösterir. Birimi Volt dur.
Pozitif bir redüksiyon potansiyeli değeri, ürünlerin (reaksiyonun sağ tarafındaki çıktılar) oluşumunu desteklerken, negatif bir değer reaksiyona giren maddelerin oluşumundan yanadır. Diğer bir deyişle, redüksiyon potansiyeli ne kadar negatifse, reaksiyon gerçekleşmekten o kadar uzaktır.
Örneğin;
Li(s) → Li+ + e- ..........Eº = 3.05 V
F2 + 2 e- → 2 F- ........Eº = 2.87 V
reaksiyonlarında, lityumun oksidasyonu ve florun redüksiyonu görülmektedir. Yazıldığı şekliyle her iki reaksiyon da pozitif E° değerine sahiptir ve yazıldıkları yönde gerçekleşmeleri beklenir. Aslında bu reaksiyonlar, bir oksidasyon (lityum) ve redüksiyon (flor) reaksiyonu için en yüksek potansiyel değerlerine sahiptirler.
E° değerleri aynı zamanda, bir redoks reaksiyonunda hangi atomun veya molekülün elektron alacağını tahmin etmek için de kullanılabilir. Örneğin, manganez ve çinkonun oksidasyon potansiyelleri pozitiftir, her iki atomun da elektronları kolayca uzaklaştırılabilir:
Zn(s) → Zn2+(**) + 2 e-...........E° = 0.763 V
Mn(s) → Mn2+(**) + 2 e-.........E° = 1.18 V
Redüksiyon potansiyelleri karşılaştırıldığında, manganezin elektronlarını uzaklaştırmaya çinkodan daha yatkın olduğu görülür. Kısacası, hem katı hem de iyon halinde manganez ve çinko içeren bir çözeltide, aşağıdaki yarı-reaksiyonlar oluşacaktır:
Zn2+(**) + 2 e- → Zn(s)...........E° = - 0.763 V
Mn(s) → Mn2+(**) + 2 e-.........E° = 1.18 V
Burada çinko redüklenmek istememesine rağmen, manganez reaksiyonunun yüksek potansiyeli, çinkoyu fazla elektronları absorbe etmesi için zorlayacaktır.
Zn2+(**) + Mn(s) → Zn(s) + Mn2+(**)........E° = 0.417
Bazı redüksiyon potansiyellerinin pozitif, diğerlerinin negatif olması, bu değerlerin nasıl ölçüldüğü sorusunu akla getirebilir. Redüksiyon potansiyellerinin ölçüldüğü bir “mutlak standart” yoktur. Bunun yerine, bilim dünyası, H+ iyonlarının hidrojen gazına redüksiyonuna ilişkin redüksiyon potansiyelinin 0.00 V olduğunu kabul etmiştir.
2H+ + 2e- → H2..........E° = 0.00 V
Bu sistem, tüm diğer redoks reaksiyonları bu değere karşı ölçüldüğü için referans elektrodu veya standart hidrojen elektrodu olarak bilinir. Daha kuvvetli oksitleyici reaktifler (pozitif redüksiyon potansiyeline sahip olanlar) hidrojeni oksitlenmeye zorlarken, daha zayıf olanlar (negatif redüksiyon potansiyeline sahip olanlar) H+ tarafından oksitlenirler. Ancak, bu değerlerin standart şartlar için geçerli olduğu unutulmamalıdır.
Sponsorlu Bağlantılar
Örneğin;
Li(s) → Li+ + e- ..........Eº = 3.05 V
F2 + 2 e- → 2 F- ........Eº = 2.87 V
reaksiyonlarında, lityumun oksidasyonu ve florun redüksiyonu görülmektedir. Yazıldığı şekliyle her iki reaksiyon da pozitif E° değerine sahiptir ve yazıldıkları yönde gerçekleşmeleri beklenir. Aslında bu reaksiyonlar, bir oksidasyon (lityum) ve redüksiyon (flor) reaksiyonu için en yüksek potansiyel değerlerine sahiptirler.
E° değerleri aynı zamanda, bir redoks reaksiyonunda hangi atomun veya molekülün elektron alacağını tahmin etmek için de kullanılabilir. Örneğin, manganez ve çinkonun oksidasyon potansiyelleri pozitiftir, her iki atomun da elektronları kolayca uzaklaştırılabilir:
Zn(s) → Zn2+(**) + 2 e-...........E° = 0.763 V
Mn(s) → Mn2+(**) + 2 e-.........E° = 1.18 V
Redüksiyon potansiyelleri karşılaştırıldığında, manganezin elektronlarını uzaklaştırmaya çinkodan daha yatkın olduğu görülür. Kısacası, hem katı hem de iyon halinde manganez ve çinko içeren bir çözeltide, aşağıdaki yarı-reaksiyonlar oluşacaktır:
Zn2+(**) + 2 e- → Zn(s)...........E° = - 0.763 V
Mn(s) → Mn2+(**) + 2 e-.........E° = 1.18 V
Burada çinko redüklenmek istememesine rağmen, manganez reaksiyonunun yüksek potansiyeli, çinkoyu fazla elektronları absorbe etmesi için zorlayacaktır.
Zn2+(**) + Mn(s) → Zn(s) + Mn2+(**)........E° = 0.417
Bazı redüksiyon potansiyellerinin pozitif, diğerlerinin negatif olması, bu değerlerin nasıl ölçüldüğü sorusunu akla getirebilir. Redüksiyon potansiyellerinin ölçüldüğü bir “mutlak standart” yoktur. Bunun yerine, bilim dünyası, H+ iyonlarının hidrojen gazına redüksiyonuna ilişkin redüksiyon potansiyelinin 0.00 V olduğunu kabul etmiştir.
2H+ + 2e- → H2..........E° = 0.00 V
Bu sistem, tüm diğer redoks reaksiyonları bu değere karşı ölçüldüğü için referans elektrodu veya standart hidrojen elektrodu olarak bilinir. Daha kuvvetli oksitleyici reaktifler (pozitif redüksiyon potansiyeline sahip olanlar) hidrojeni oksitlenmeye zorlarken, daha zayıf olanlar (negatif redüksiyon potansiyeline sahip olanlar) H+ tarafından oksitlenirler. Ancak, bu değerlerin standart şartlar için geçerli olduğu unutulmamalıdır.

 Elektrokimyasal Potansiyel Dizisi
Elektrokimyasal Potansiyel Dizisi
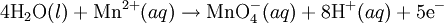
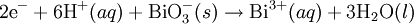

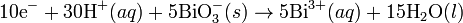
 Alkali Ortam
Alkali Ortam 



 Dengelenmiş Denklem:
Dengelenmiş Denklem: Nötr Ortam
Nötr Ortam