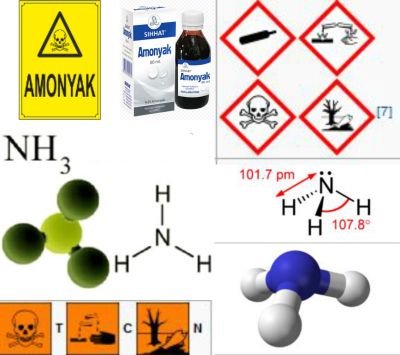
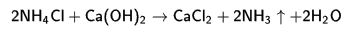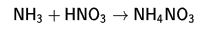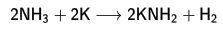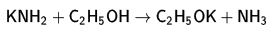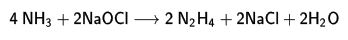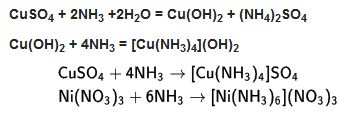AMONYAK
a (fr ammoniac; lat. ammoniacum; yun. Ammoniakon, mısır tanrısı Amonun yun. adı Ammöridan; çünkü bu madde eskiden Libyada bu tanrının tapınağı yanında hazırlanırdı).
1. Azot ve hidrojenden oluşan, NH3 formüllü, gaz halinde bileşik.
2. Bu gazın sudaki çözeltisi. (Uzun süre NH4OH formülüyle tanımlanan bir bileşik sanıldı.)
3. Amonyak tuzu, amonyum klorürün ticari adı. ll Amonyakta yüksettgenme, bir hidrokarbonun amonyak eşliğinde katalitik yükseltgenmesi. (Bk. ansikl. böl.)
El sant. Amonyak odası, anilin siyahının amonyak buharının etkisiyle koyu siyaha dönüşmesini sağlamak üzere, yazmaların asıldığı, içinde amonyak dolu kaplar bulunan oda. (Eşanl. İLAÇ ODASI.) [Bk. ansikl. böl.].
ANSİKL. El sant. Eskiden amonyak odası yerine ahırlar kullanılırdı. Amonyak buharının etkisiyle koyulaşıp sabitleşmesi istenen yazmalar, ahıra asılarak bir süre bekletilirdi. Günümüzde bu işlem için, içinde amonyak dolu kaplar bulunan bir oda kullanılmaktadır.
Kim. Amonyak çözeltisi XV. yy.dan bu yana bilinmektedir. 1774'te Priestley bu maddeyi gaz halinde elde etti. 1785te Berthollet kesin bileşimini belirledi.
Özellikleri.
Renksiz, keskin kokulu ve göz yaşartıcı bir gazdır; yakıcı bir tadı vardır ve havadan hafiftir (yoğunluğu 0,60). Atmosfer basıncı altında,-33°Cta kolayca sıvılaşır; sıvı amonyak soğutucu ve çözücü olarak kullanılır. Amonyak gazının sudaki çözünürlüğü çok yüksektir; 0°Cta bir hacim suda T 000 hacim amonyak çözenebilir. Özgül kütlesi 0,92 g/cm3 olan ticari amonyak çözeltisi, % 20 amonyak içerir ve soğutulursa çökelek biçiminde birçok hidrat verir. Amonyak gazı ısıtıldığında bozunarak azot ve hidrojene dönüşür. Arı oksijende ise, soluk bir alevle yanarak su buharı ve azot oluşturur. Ama amonyak-oksijen karışımı hafifçe ısıtılmış platin köpüğünden geçirilirse, nitrik asit elde edilir. Öte yandan toprakta amonyak bileşikleri, benzer yükseltgenme geçirerek nitratlara dönüşür; bu tepkimeye nitratlaşma denir. Klor ve brom ise, soğukta amonyağı bozundurur. iyotla tepkimeye girdiğinde, kararsız bir katı olan azot iyodür ortaya çıkar.
Amonyak asitlerle tepkimeye girdiğinde, amonyum tuzları oluşur. Bu tuzlar tetraedrik NHJ iyonunu içerir.
Çok sayıda tuz amonyağı soğurarak, amonyaklı gütmüş klorür gibi amonyakat- lara dönüşür. Amonyakatlar, hidratlar gibi tekdeğişkenli dengelere göre ayrışabilir.
Sıvı amonyağın çiftkutuplu momenti oldukça yüksektir (1,49 D). Dolayısıyla suya göre zayıf bir çözücüdür ve iyonik bileşikleri çok daha güç çözer. Buna karşılık, kutuplaşmayan bileşikler ve iyodürler gibi kuvvetlice kutuplaşan anyonlar için çok iyi bir çözücü oluşturur. Serbest çift bağı ve çitfkutuplu momenti, amonyağın İyonlaştırıcı bazik bir çözücü olmasına yol açar. Su gibi sıvı amonyak da aşağıdaki tepkime uyarınca özprotoliz olayına uğrar:
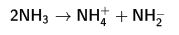
Doğal durumu ve hazırlanışı.
Azotlu organik maddeler, kimi mayaların etkisiyle bozunarak amonyak oluşturur; nitekim eskiden lağım suları önemli bir amonyak kaynağıydı. Taşkömürünü damıtarak da amonyak elde edilebilir. Ama sanayi boyutunda en önemli hazırlama yöntemi, dolaysız bireşimdir:
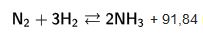
+91,84 kJ bu yöntemi iki alman, Haber ve Bosch 1913 yılında geliştirmiştir. Böyle bir bireşim ancak yüksek basınç altında gerçekleştirilir: "alçak basınç yöntemlerinde (Haber-Bosch, Fauser, Linde) 200 ile 300 bar, "orta basınç" yöntemlerinde (Casale) 400 ile 700 bar ve "yüksek basınç yöntemlerinde de (Claude) 700 ile 1 000 bar arasında basınç uygulamak gerekir. Sıcaklık ise, 475 ile 600°C arasında değişir. Öte yandan, bu konuda dolaylı yöntemler de kullanılmış, ama günümüzde terk edilmiştir; bu yöntemlerde kalsiyum siyanamit, alkali siyanürler ya da alüminyum nitrür kullanılıyordu.
Amonyağın kullanımı.
Amonyak çok önemli bir bileşiktir. Amonyak tuzları, özellikle sülfat, azotlu gübre olarak kullanılır. Ayrıca sanayide çok miktarda amonyağın, nitrik aside, nitratlara ve nitritlere dönüştürüldüğünü belirtmek gerekir; öte yandan Solvay yöntemiyle sodyum karbonatın hazırlanmasında ve ürenin bireşim yoluyla elde edilmesinde de amonyaktan yararlanılır. Amonyak çözeltisi kimyada çok kullanılan tepkin maddelerden biridir; gümüş eşyayı temizlemek, kumaşların yağını gidermek için amonyağa başvurulur; tıpta kostik olarak kullanılır; bir bardak su ile birkaç damla amonyak sarhoşluğu gidermek için yeterlidir. Nihayet amonyaktan soğutucu akışkan olarak yararlanılır.
Amonyağın sanayideki bireşimi.
Tarımda yapay gübre gereksinimi, kullanılan amonyak miktarının gittikçe artmasına neden olmuştur; amonyak üretiminin hemen hemen tümü, petrol kökenli hidrojen ile havanın azotu kullanılarak petrokimyasal bireşim yoluyla sağlanır; üretim birimleri rafinerilerin ya da doğal gaz işleme fabrikalarının bir parçasını oluşturur.
Amonyak üretimi üç evreli bir süreç içinde gerçekleştirilir (Kellogg yöntemi).
1. Birinci evrede doğal gazın, rafineri gazının ya da ağır benzinin buharla krakingi yoluyla hidrojen üretilir:
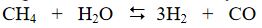
Hidrokarbon, yaklaşık 25 barlık bir basınç altında, 800 ile 1 000°C arasında nikel katalizör eşliğinde bozundurulur.
2. işlemin ikinci evresinde hidrojen ve azot karışımı hazırlanır. Azot doğrudan ya da sıvılaştırma yoluyla havadan sağlanır; bu arada elde edilen sıvı oksijen, özellikle demir-çelik sanayisinde aranan değerli bir üründür. Yukarıdaki tepkimede açığa çıkan gazlar, hava eşliğinde 400°C dolayında reforming işlemine tutularak karbon monoksit. karbon diokside(CO2) dönüştürülür; CO2 kolayca ortamdan uzaklaştırılır ve hidrojen ile azot oranı ayarlanır.
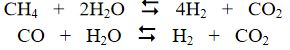 3.
3. Sonuncu evrede tam anlamıyla amonyağın bireşimi sağlanır:
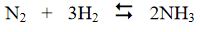
işlemin ısıveren bir tepkime olması yüzünden, sıcaklık yükseldikçe amonyak oluşumu olumsuz yönde etkilenir. Buna karşılık, düşük sıcaklıklar kinetik sorunlar doğurur. Dolayısıyla verimi artırmak için katalizör kullanımı zorunludur. Tepkime değiştirgeç (konverter) adı verilen boru bi çiminde özel bir kapta, demirli katalizör eşliğinde gerçekleştirilir.
Buharla kraking yerine oksijenle krakinge de başvurulabilir; ancak bu işlem havayı sıvılaştırma kuruluşu gerektirir. Bununla birlikte, bu yöntem hammadde olarak ağır fuel-oil kullanma üstünlüğü gösterir. Hidrokarbonlar, oksijen eşliğinde basınç ve sıcaklığın ortak etkisiyle ayrıştırılır. Elde edilen gaz halindeki ürünler katalitik oksijenlemeyle dönüştürülür, sonra katışkıları (CO2) elemek ve
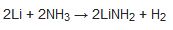
bireşim karışımının azot oranını ayarlamak için sıvı azotla yıkanır. Bu kuruluşlar bazen üre
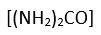
bireşim birimiyle tamamlanır; bu birimde amonyak karbon dioksitle tepkimeye girerek üre verir, iki tür üre üretilir; birinci tür gübre, ikinci tür plastik üretiminde kullanılır. Günümüzde amonyak üretimi hızla gelişmektedir; başlıca sanayi ülkeleri yılda milyonlarca ton amonyak üretecek kuruluşlarla donatılmıştır.
Amonyak laboratuvarda elde etmek
1.

2.
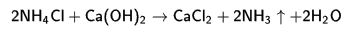
Kimyasal özellikleri
1. asit ile 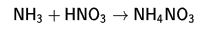 2. metal ile
2. metal ile
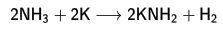
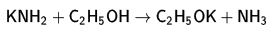
3. ayrışma
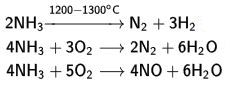
4. hipoklorit ile
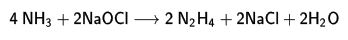
5. bileşik oluşması
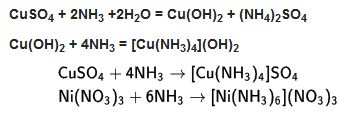
-Derlemedir-


 Amonyak ve Kullanım Alanları
Amonyak ve Kullanım Alanları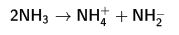
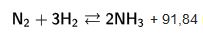 +91,84 kJ bu yöntemi iki alman, Haber ve Bosch 1913 yılında geliştirmiştir. Böyle bir bireşim ancak yüksek basınç altında gerçekleştirilir: "alçak basınç yöntemlerinde (Haber-Bosch, Fauser, Linde) 200 ile 300 bar, "orta basınç" yöntemlerinde (Casale) 400 ile 700 bar ve "yüksek basınç yöntemlerinde de (Claude) 700 ile 1 000 bar arasında basınç uygulamak gerekir. Sıcaklık ise, 475 ile 600°C arasında değişir. Öte yandan, bu konuda dolaylı yöntemler de kullanılmış, ama günümüzde terk edilmiştir; bu yöntemlerde kalsiyum siyanamit, alkali siyanürler ya da alüminyum nitrür kullanılıyordu.
+91,84 kJ bu yöntemi iki alman, Haber ve Bosch 1913 yılında geliştirmiştir. Böyle bir bireşim ancak yüksek basınç altında gerçekleştirilir: "alçak basınç yöntemlerinde (Haber-Bosch, Fauser, Linde) 200 ile 300 bar, "orta basınç" yöntemlerinde (Casale) 400 ile 700 bar ve "yüksek basınç yöntemlerinde de (Claude) 700 ile 1 000 bar arasında basınç uygulamak gerekir. Sıcaklık ise, 475 ile 600°C arasında değişir. Öte yandan, bu konuda dolaylı yöntemler de kullanılmış, ama günümüzde terk edilmiştir; bu yöntemlerde kalsiyum siyanamit, alkali siyanürler ya da alüminyum nitrür kullanılıyordu.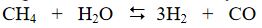
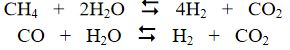
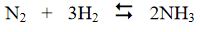
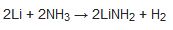 bireşim karışımının azot oranını ayarlamak için sıvı azotla yıkanır. Bu kuruluşlar bazen üre
bireşim karışımının azot oranını ayarlamak için sıvı azotla yıkanır. Bu kuruluşlar bazen üre 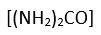 bireşim birimiyle tamamlanır; bu birimde amonyak karbon dioksitle tepkimeye girerek üre verir, iki tür üre üretilir; birinci tür gübre, ikinci tür plastik üretiminde kullanılır. Günümüzde amonyak üretimi hızla gelişmektedir; başlıca sanayi ülkeleri yılda milyonlarca ton amonyak üretecek kuruluşlarla donatılmıştır.
bireşim birimiyle tamamlanır; bu birimde amonyak karbon dioksitle tepkimeye girerek üre verir, iki tür üre üretilir; birinci tür gübre, ikinci tür plastik üretiminde kullanılır. Günümüzde amonyak üretimi hızla gelişmektedir; başlıca sanayi ülkeleri yılda milyonlarca ton amonyak üretecek kuruluşlarla donatılmıştır.