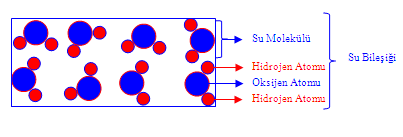
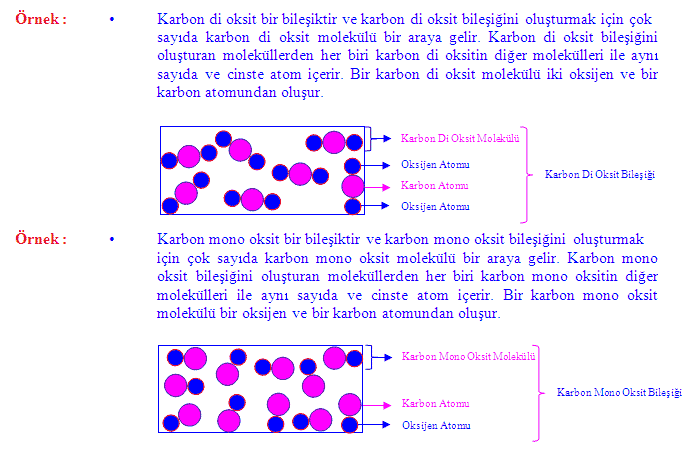
kimyasal bileşikler
iki ya da daha çok elementin atomlarını içeren özdeş moleküllerin oluşturduğu maddeler. Doğal olarak bulunan ya da bireşim yoluyla hazırlanan birbirinden farklı milyonlarca kimyasal bileşik vardır. Bunlar bir oksijen atomuna iki hidrojen atomunun bağlanmasıyla oluşan su molekülü gibi basit yapılı olanlardan binlerce atomdan oluşan nükleik asitler gibi karmaşık yapıda olanlara kadar çeşitlilik gösterir.
Sponsorlu Bağlantılar
Kimyasal bileşikler başlıca, bileşimlerindeki elementlere, moleküllerindeki atomlar arası bağların türüne ve girdikleri kimyasal tepkimelere göre üç ana grupta sınıflandırılır.
BİLEŞİMDEKİ ELEMENTLERE GÖRE SINIFLANDIRMA.
Organik bileşikler.
19. yüzyıl başlannda kimyacılar yalnızca canlılardan türediğini sandıkları karbon bileşiklerini organik, mineraller gibi cansız maddelerdeki bileşikleri ise inorganik olarak ikiye ayırdılar. Ancak, sonraları laboratuvarda inorganik bileşiklerden organik bileşiklerin bireşimlenebileceğinin anlaşılması üzerine, bu görüşün doğru olmadığı ortaya çıktı ama kimyanın karbon bileşikleriyle ilgilenen dalı için hâlâ organik kimya terimi kullanılır.
Karbon atomları, birbiriyle ve başka elementlerle ortaklaşım bağı oluşturabilme özelliğinden ötürü öbür kimyasal elementlerden üstündür. Karbon, atom yapısı nedeniyle elektron alma ya da kaybetme yerine, elektron paylaşımına daha yatkındır. Bir karbon atomu, dört bağ oluşturabildiğinden, aynı anda başka bir karbon atomunun yanı sıra öbür elementlere ya da bileşiklere de bağlanabilir. Bu özelliği nedeniyle çok sayıda büyük moleküllü ve karmaşjk bileşik oluşturur. Karbonun en çok rastlanan bileşikleri hidrojen, oksijen, azot, klor ve kükürtle yaptığı bileşiklerdir.
Canlıları oluşturan maddelerin büyük bir bölümü organik bileşiklerdir. Gıdaların başlıca bileşenleri olan yağlar, proteinler ve karbonhidratlar ile hemoglobin, klorofil, enzimler, hormonlar ve vitaminler gibi yaşamsal önemi olan maddeler organik bileşiklerin en önemli üyeleridir. Doğal ve yapay elyaflar, bazı yakıtlar, ilaçlar ve plastikler gibi günlük yaşamda kullanılan çeşitli malzemeler de organik kökenli maddelerdir.
Organik bileşikler bileşimlerine ve yapılarına göre çeşitli sınıflara ayrılır. Örneğin, hidrokarbonlar yalnızca karbon ve hidrojen elementlerinden oluşan organik bileşikler sınıfıdır; düz ya da dallanmış zincir yapısında, doymuş (alkanlar) ya da doymamış (alkenler, alkinler) hidrokarbonlara alifatik hidrokarbonlar, halkalı yapıdaki hidrokarbonlara da aromatik hidrokarbonlar adı verilir. Organik bileşikler işlevsel gruplarına göre de sınıflandırılabilir; alkoller, aldehitler, ketonlar ve karboksilii asitler bunun en tipik örnekleridir.
Organik bileşikler bitki, hayvan, petrol ve kömür gibi doğal kaynaklardan elde edilebildiği gibi moleküler yapının yeniden düzenlenmesine ve küçük moleküllerden büyük moleküllerin oluşturulmasına dayalı kimyasal işlemlerle bireşimsel olarak da hazırlanabilir.
Doğal ya da yapay hidrokarbon karışımlarından organik ürünlerin elde edilmesinde damıtma, kristallendirme, özütleme ve yüze tutma gibi çeşitli ayırma yöntemlerinden yararlanılır.
Organik tepkimelerin çoğunun tersinir olması organik maddelerin molekül yapısının çözümlenmesini kolaylaştırır. Bu amaçla, organik moleküller bilinen kimyasal tepkimelerle yapıları bilinen küçük moleküllere aşamalı olarak parçalanır. Araştırılan maddenin ışık soğurma desenleri ile magnetik desenlerini çözümleyebilen elektronik aygıtlardan da yararlanılır. Ayrıca, en küçük organik molekülden başlayarak maddeyi yeniden üretmek yoluyla da bulguların doğruluğu kanıtlanabilir.
Ortaklaşım bağlarının parçalanması gereken organik tepkimelerde, tepkime hızının artırılması için işlem çoğunlukla yüksek sıcaklıklarda yapılır. Çok yüksek sıcaklıkların tepkimeyi ters yönde etkilediği durumlarda ise, tepkimeyi hızlandırmak amacıyla katalizörler kullanılır.
Organik bileşikler çok çeşitli tepkimelere girerler. Bunların en önemlilerinden biri elektronsuz bir hidrojen atomunun bir asitten bir baza aktarıldığı asit-baz tepkimesidir. Katılma tepkimesinde ise bir molekül bir başka moleküle katılarak yeni, tek bir molekül oluşur. Karbon atomuna bağlı bir hidrojen atomunun yerine başka bir maddenin geçmesi ornatma tepkimesi olarak bilinir. Yer değiştirme tepkimesinde molekülün bir bileşeni başka bir bileşenle yer değiştirir. Hidroliz, bir molekülün suyla verdiği ayrışma tepkimesi, piroliz ise bir molekülün ısıyla bozunmasıdır. Gene organik bileşiklerin önemli tepkimelerinden biri de çok sayıda küçük molekülün birbirine bağlanmasıyla molekül ağırlığı büyük bileşiklerin oluştuğu polimerleşme tepkimesidir.
İnorganik bileşikler.
İnorganik bileşikler karbon dışındaki kimyasal elementlerin ikisinin ya da daha fazlasının hemen her zaman belirli oranda birleşmesiyle oluşan maddelerdir. Çok değişik yapısal özelliklere sahip olan bu bileşikler genellikle elementlerine göre sınıflandırılırlar; bu yöntem daha çok yalnızca iki elementin atomlarından oluşan ikili bileşikler için uygundur. Örneğin, sodyum metaliyle klordan oluşan sodyum klorür (sofra tuzu) bileşiği gibi, çeşitli metallerin klorla yaptığı bileşikler klorürler grubunu oluşturur. Bu sınıflandırma biçimi klor ailesinin öbür elementleri yani flüor, iyot ve brom için de geçerlidir. Hidrojenin oluşturduğu hidrürler, oksijenin oluşturduğu oksitler, kükürdün oluşturduğu sülfürler de tek bir elemente göre sınıflandırılmış ikili bileşik örnekleridir. İkiden çok elementten oluşan inorganik bileşiklerin sınıflandırılmasında da benzer ilkelerden yararlanılır.
Organometal bileşikleri.
Metal atomlarının organik bileşiklerle oluşturduğu bu maddelere canlıların yapısında sıklıkla rastlanır. Örneğin, üstün yapılı hayvanların kanında bulunan ve bir demir atomuyla birleşmiş karbon bileşiği olan hemoglobin ile yeşil bitkilerdeki, magnezyumla bağlanmış büyük bir organik molekül olan klorofil en iyi bilinen organometal bileşikleridir.
Bileşenlerinin oranlan tam sayı olmayan (stokiyometrik olmayan) bileşikler.
Çoğu bileşikte, atomların tam sayılı oranlarda birleşmiş olmasına karşılık, özellikle bazı metallerin oksit ve sülfürlerindeki gibi bu oranın tam sayı olmadığı bileşiklere de rastlanır. Örneğin, çinko sülfürdeki (ZnS) çinko atomlarının sayısı kükürt atomlarının sayısından yüzde 0,03 kadar fazladır. Gene, seryum sülfür bileşiğinde
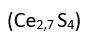 de seryum atomlarının kükürt atomlarıyla 2,7ye 4 oranında birleştiği bilinmektedir. Bu tür bileşikler, özgün elektriksel iletkenlikleri nedeniyle elektronik sanayisinde yarıiletken elektronik aygıtların yapımında kullanılır.
de seryum atomlarının kükürt atomlarıyla 2,7ye 4 oranında birleştiği bilinmektedir. Bu tür bileşikler, özgün elektriksel iletkenlikleri nedeniyle elektronik sanayisinde yarıiletken elektronik aygıtların yapımında kullanılır.KİMYASAL BAĞIN TÜRÜNE GÖRE SINIFLANDIRMA.
İyon bileşikleri.
Atomların iyon bağıyla bir arada tutulduğu bu bileşiklerin başında tuzlar ve mineraller gelir. Bazı elementlerde atomların çekirdeklerinin elektronları çekme gücü öbür elementlere göre daha fazladır. Örneğin, bu tür bir atom olan klor, sodyum atomundan bir elektron alarak eksi yüklü iyon, elektron kaybeden sodyum atomu da artı yüklü iyon haline geçer ve bir iyon bileşiği olan sodyum klorür oluşur. Elektrostatik çekimle bir arada tutulan iyon bileşikleri genel olarak ortaklaşım bağlı bileşiklerden farklı özelliklere sahiptir. Bunlar genellikle erime noktalan yüksek, kararlı ve sert maddeler olma- lanna karşılık ortaklaşım bağlı bileşikler çoğunlukla sıvıdır ya da erime noktası düşük katilardır. Ancak, bu iki bağ tipi arasındaki fark mutlak değildir. Pek çok ortaklaşım bağı kısmen iyon bağı özelliği de gösterir.
Ortaklaşım bağlı bileşikler.
Atomlann, elektronlann paylaşılması sonucu oluşan ortaklaşım bağıyla birbirine bağlandığı bu bileşiklerin başında karbon bileşikleri gelir. Bunlarda moleküller arası kuvvetler elektrostatik kuvvetlerden daha zayıf olduğundan, moleküller iyon bileşiklerine göre birbirinden daha kolay ayrılabilir. Ortaklaşım bağı sayesinde binlerce ya da daha çok atomun birleşmesiyle polimer adı verilen makromoleküller oluşabilir. Günlük yaşamda sıkça yararlanılan plastikler ile canlıların temel yapı öğesi olan proteinler, karbonhidratlar ve nükleik asitler ortakla- şım bağlı polimerlerdir. Ayrıca, kuvars (
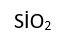 ) ve kil gibi silisyum mineralleri de ortaklaşım bağlı makromoleküller olarak sınıflandırılan inorganik bileşiklerdir.
) ve kil gibi silisyum mineralleri de ortaklaşım bağlı makromoleküller olarak sınıflandırılan inorganik bileşiklerdir.Düzenleşim bileşikleri. Merkezdeki bir metal atomuyla, bu atomu çevreleyen atomlardan ya da atom gruplarından oluşan bu bileşiklerdeki bağlar, elektronlar yalnızca bir atom tarafından verildiği için tipik ortaklaşım bağı değildir. Örneğin, bakır sülfatın (
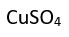 ) amonyakla (
) amonyakla ( ) tepkimeye girmesiyle oluşan tetraamminbakır (II) sülfat [
) tepkimeye girmesiyle oluşan tetraamminbakır (II) sülfat [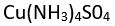 ] bileşiği bir düzenleşim bileşiğidir. Geçiş elementleri olarak bilinen elementler çeşitli düzenleşim bileşikleri oluşturur.
] bileşiği bir düzenleşim bileşiğidir. Geçiş elementleri olarak bilinen elementler çeşitli düzenleşim bileşikleri oluşturur.KİMYASAL TEPKİNLİĞE GÖRE SINIFLANDIRMA.
Kimyasal bileşiklerin sınıflandırılmasında kullanılan önemli bir başka yöntem de kimyasal tepkinliğe göre sınıflandırmadır.
Asitler, bazlar ve tuzlar.
Bazı belirteçlerin rengini değiştiren (mavi turnusol kâğıdını kırmızılaştıran) ve bazı metallerle tepkimeye girerek hidrojen açığa çıkaran bileşikler asit, bu bileşiklere karşıt bir kimyasal etki gösteren bileşikler ise baz adı altında sınıflandırılır.
Asitlerin bazlarla tepkimeye girmesi sonucunda da tuz olarak bilinen bileşikler sınıfı oluşur.
Yükseltgen ve indirgenler.
Bileşikleri yükseltgeme-indirgeme tepkimelerindeki davranışlarına göre sınıflandırma da sıkça kullanılan bir yöntemdir. Bir element atomundan elektronlann uzaklaştınlmasıyla o element yükseltgenir, elektron katılmasıyla da indirgenir. Bu tür tepkimelerde bileşiklerin bileşenlerinden bazılarının değerlikleri değişir.
Bu üç ana grubun dışında bileşikler bazen fiziksel hallerine göre gaz, sıvı ve katı; kaynağına göre doğal ve yapay olarak da sınıflandınlırlar.
Bileşiklerin Genel Özellikleri
- Bileşiklerin çoğu moleküler yapıdadır. Ama tuz gibileri atomik yapıdadır.
- Bileşikler belirli fomüllerle ifade edilirler.
- Bileşikleri asitler, bazlar, oksitler, tuzlar olarak sınıflandırılır.
- Bileşikler oluştukları element atomlarının özeliğini taşımazlar. Örneğin tuz ikisi de zehirli olan sodyum ve klorürden oluşur. Fakat soframıza lezzetli yemek tuzu olarak gelirler. Su yakıcı olan oksijen ve yanıcı olan hidrojenden meydana gelir. Ama kendisi söndürücüdür.
- Homojendirler.
- Belirli erime ve kaynama noktaları vardır.
Bileşikle Karışımın Farkı
Bileşikler belirli sayıda element atomunun kimyasal bir bağ ile bağlanmasıyla oluşur. Ancak karışımın belirli bir formülü yoktur. Bileşikleri oluşturan elementler bir araya gelerek kendi özelliklerini kaybederler, fakat karışımları oluşturan maddeler kendi özelliklerini kaybetmezler.
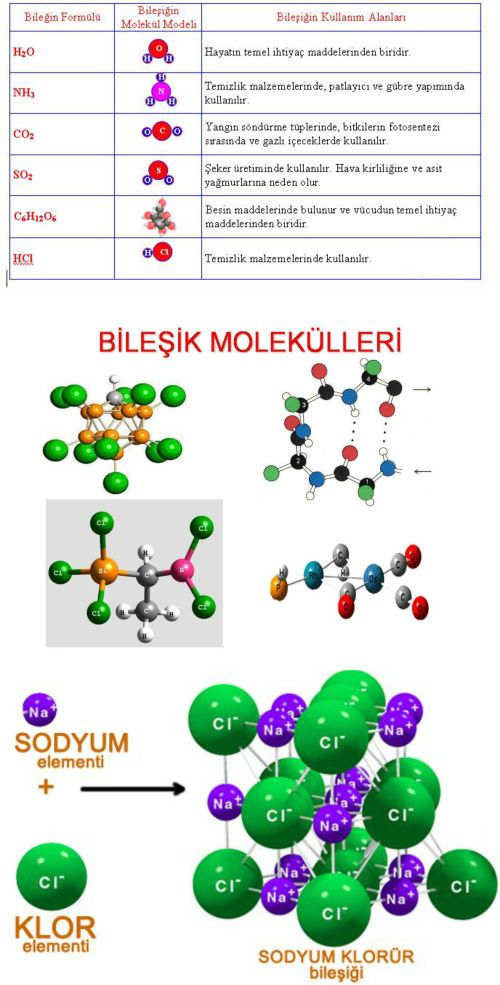
Bazı Bileşiklerin İsim ve Formülleri


kaynak: Ana Britannica
BAKINIZ Bileşiklerin Ayrışması
Son düzenleyen Safi; 26 Kasım 2016 05:49
Tanrı varsa eğer, ruhumu kutsasın... Ruhum varsa eğer!

 Bileşik Nedir? Bileşikler ve Özellikleri Hakkında Genel Bilgiler
Bileşik Nedir? Bileşikler ve Özellikleri Hakkında Genel Bilgiler