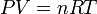Gaz Yasaları
MsXLabs.org & Vikipedi, özgür ansiklopedi
Gaz yasaları, gazlardaki termodinamik sıcaklık [T], basınç [P] ve hacim [V] aralarındaki ilişkileri açıklayan bir takım kanundur. Rönesans'ın geç dönemleriyle 19. yüzyıl arasındaki dönemde bulunmuş birkaç yasadan oluşur.
İdeal Gazlar
En baştaki gaz yasaları - Boyle yasası (1662), Charles yasası (1787-1802) ve Gay-Lussac yasası (1809) - birleşip, toplam gaz yasını oluştururlar:
Diğer önemli gaz yasaları olan Dalton yasası, kinetik teori ve Graham yasası da gazların basınç, hacim ve sıcaklığa göre nasıl davrandıklarını açıklar.
Bu yasaların tamı tamına geçerli olduğu tüm gazlara, ideal gaz denir. İdeal bir gaz yoktur ancak bazı gazlar, bu yasalara daha çok uyabilir.
İdeal Olmayan Gazlar
Van der Waals denklemi gibi diğer gaz yasaları, ideal gaz yasalarının yapamadığını yapıp, gerçekte gazların hareketlerini belirlemeye çalışır. Van der Waals denklemi, ideal gaz yasasını değiştirip, van der Waals sabitleri adı altında toplanabilecek birçok hesaplama yaparak, bunu başarmayı amaçlar. Ayrıca Boltzmann'ın analizini kullanarak gazlar hakkında daha çok bilgiler edinilebilir.
MsXLabs.org & Vikipedi, özgür ansiklopedi
Sponsorlu Bağlantılar
Gaz yasaları, gazlardaki termodinamik sıcaklık [T], basınç [P] ve hacim [V] aralarındaki ilişkileri açıklayan bir takım kanundur. Rönesans'ın geç dönemleriyle 19. yüzyıl arasındaki dönemde bulunmuş birkaç yasadan oluşur.
İdeal Gazlar
En baştaki gaz yasaları - Boyle yasası (1662), Charles yasası (1787-1802) ve Gay-Lussac yasası (1809) - birleşip, toplam gaz yasını oluştururlar:
Daha sonra Avogadro yasasının da eklenmesiyle ideal gaz yasası oluşmuştur: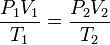
- P paskal olarak basınç,
- V kübik metre olarak hacim,
- n gazın mol sayısı,
- R gaz sabiti (8.3145 J/(mol K)),
- T de Kelvin olarak sıcaklıktır.
Diğer önemli gaz yasaları olan Dalton yasası, kinetik teori ve Graham yasası da gazların basınç, hacim ve sıcaklığa göre nasıl davrandıklarını açıklar.
Bu yasaların tamı tamına geçerli olduğu tüm gazlara, ideal gaz denir. İdeal bir gaz yoktur ancak bazı gazlar, bu yasalara daha çok uyabilir.
İdeal Olmayan Gazlar
Van der Waals denklemi gibi diğer gaz yasaları, ideal gaz yasalarının yapamadığını yapıp, gerçekte gazların hareketlerini belirlemeye çalışır. Van der Waals denklemi, ideal gaz yasasını değiştirip, van der Waals sabitleri adı altında toplanabilecek birçok hesaplama yaparak, bunu başarmayı amaçlar. Ayrıca Boltzmann'ın analizini kullanarak gazlar hakkında daha çok bilgiler edinilebilir.
Tanrı varsa eğer, ruhumu kutsasın... Ruhum varsa eğer!

 Gaz Yasaları
Gaz Yasaları