AZOT (NİTROJEN)
1. Hacim bakımından havanın yaklaşık beşte dördünü oluşturan ve olağan sıcaklıkta gaz halinde bulunan madde. (Simgesi N olan kimyasal element.)
2. Amonyak azotu, hidrojenle bileşerek NH4 kimyasal kökünü oluşturan azot.
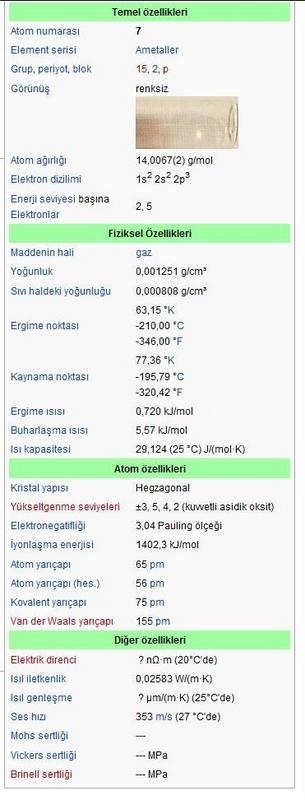
- Atom sayısı: 7
- Atom kütlesi: 14,006 7
- Erime noktası:-195,8°C
- Kaynama noktası:-210°C
- Havaya göre yoğunluğu: 0,97
- Yükseltgeme dereceleri: -3,-2,-1, 0, +1, +2, +3, +4, +5
- Elektron biçimlenmesi: s2p3
- izotopları: 12, 13, 14, 15, 16, 17
- Doğal azot: 14N (% 99, 65), 15N (% 0,35)
Biyokim. Proteikazot, bir dokudaki ya da biyolojik bir sıvıda proteinlerde bulunan azot miktarı. (Proteinlerde ortalama % 15-20 azot bulunur.) Proteik olmayan azot, bir dokudaki ya da biyolojik bir sıvıdaki proteinlerden başka maddelerde bulunan azot.
Biyol. Azot bakterisi, NİTROZOBAKTERİ' nin eşanlamlısı.
Çevrebil ve Tarım. Azot dolaşımı, azotun madenler, bitkiler ve hayvanlar âlemi arasında dolaşımından oluşan değişiklikler dizisi.
Fişekç. Azot pamuğu, güçlü patlayıcı özellikler kazandırmak için nitrolanmış, azot oranı oldukça yüksek pamuk.
Petrokim. Azot giderme, doğal gaz içinde bulunan azotu kısmi olarak özütleme. (Gelişmiş azot giderme fabrikalarında, doğal gazın içerdiği azotun büyük bölümü -100°C'ta sıvılaştırma ve bölümlü damıtma yoluyla elenerek, gazın ısıl gücü artırılır.)
ANSİKL. Özellikleri. 1772'de Daniel Rutherford hava içindeki azotu saptadı, Cavendish bu maddeyi inceledi (1784), Lavoisier de, basit bir cisim olduğunu kanıtladı.
Azot, renksiz, kokusuz ve sıklaştırılması zor bir gazdır (kritik sıcaklığı:-146°C). Çözünürlüğü oldukça zayıftır: 0°C'ta, 1 litre suda ancak 23 cm3'ü çözünür.
Azot, üç değerli bir ametal türüdür. Düşük sıcaklıkta kimyasal etkinlik göstermemesi nedeniyle bu şekilde adlandırılmıştır. Öte yandan yüksek sıcaklıkta tekatomlu hale dönüştüğü için etkinlik gösterir. Tepkimelerinden birçoğu doğada ve sanayide oynadıkları rolden dolayı çok önemlidir. Azot, uygun sıcaklık aralığında hidrojenle tersinir bir tepkimeye girerek amonyağı oluşturur: N2+3H2=!2NH3. Tepkime, amonyak oluşurken ısı vericidir; dolayısıyla sıcaklık düştükçe amonyak veriminin artması gerekir; ancak bu kez tepkimenin hızı düşer. Bununla birlikte demir kökenli bir katalizör yardımıyla işlem, 550°C'ta uygulanabilir. Amonyak oluşturan tepkime, ortamdaki mol sayısının azalmasına yol açtığından, bireşimi kolaylaştırmak için yüksek basınç uygulanır. Bu bileşiğin sanayideki bireşimi işte bu yöntemle gerçekleştirilir.
Azotun bir başka önemli tepkimesi, oksijenle bileşerek azot monoksit oluşturmasıdır:
N2+02 = 2NO.
Bu tersinir tepkime ısı alıcıdır ve dolayısıyla yüksek bir sıcaklık gerektirir. Gaz karışımı önce bir elektrik arkı üstüne gönderilir; sonra çok düşük nicelikte oluşan oksidin bozunmasını önlemek İçin gazlar hızla soğutulur; çünkü 600°C'ın altında serbest oksijen, azot monoksidi, azot diokside dönüştürür:
Bu bileşikten de asit elde edilir. Ancak bu yöntem, amonyak yükseltgenerek azot monoksit elde edilmesi karşısında önemini yitirmektedir. (Bir gaz karışımının azot içerip içermediğini anlamak ve azot niceliğini saptamak için eskiden beri kullanılan aşağıdaki ayraçlara başvurulur: oksijen ve kıvılcım, pirogallik asit, sodyum hidrostit vb. Bu ayraçlarla uygulanan işlemlerden sonra bir gaz artığı kalırsa, bu artık ya azot ya da bir soy gazdır. Artık gazlardan azotu, yalnızca kalsiyum ya da kızıl hale gelinceye değin ısıtılan magnezyum soğurabilir.
Organik bir bileşikteki azot, bu madde kireçle ısıtılarak belirlenebilir ve azot genellikle amonyak biçiminde açığa çıkar. Daha güç, ama daha güvenilir bir yol ise, bu bileşiğin küçük bir miktarını sodyum ile ısıtmaktır; azot içeren organik bileşikler bu kez sodyum siyanür oluşturur; sodyum siyanür ise tam yansız çözelti halinde, demir II ve demir III tuzlan karışımına dokunduğunda Prusya mavisi çökeltisi oluşturmasıyla tanınır.
Doğal hali, hazırlanması ve kullanım alanları.
Azot, serbest halde havanın hacimce % 78'ini, ağırlık bakımından da % 75,5'ini oluşturur. Minerallerde, nitratlar ve amonyak tuzları biçiminde yer alır. Nihayet proteinlerin, nükleik asitlerin bileşimine girer ve canlı varlıkların organlarında bileşik halinde bulunur.
Sanayide azot, büyük ölçüde bedava ve tükenmez bir kaynak olan havadan üretilir. Genellikle sıvı hava bölümsel damıtmadan geçirilerek azot elde edilir. Bu element gübre üretiminde ve özellikle amonyağın bireşiminde çok büyük miktarlarda kullanılır. Sözkonusu üretim yöntemlerinde kullanılan azotun, katalizörlerin 02, CO ve CO2 gibi zehirlere karşı duyarlılığı nedeniyle oldukça arı olması zorunludur. Ayrıca kalsiyum karbür üzerine azotun etkimesiyle elde edilen kalsiyum siyanamit üretimi de çok arı azot gerektirir. Öte yandan, istenmeyen tepkimeleri önlemek için azottan çoğu kez koruyucu ve yansız gaz olarak yararlanılır. Patlama tehlikesine karşı tutuşabilir sıvıların depolanmasında ve haznelerden basınç altında gaz aktarılmasında da azot kullanılır. Çeşitli maddelerin oksijenle bozunmasını engellemek için besin ve dokuma sanayilerinde azot geniş ölçüde tüketilen bir maddedir.
Azotun Metal Bileşikleri
Azot, az çok yüksek sıcaklıklarda çeşitli metallerle birleşerek ya amonyağın ornatma türevleri olan nitrürleri, ya da azotür asidin (HN3) tuzları olan azotürleri oluşturur. Üç tür nitrür vardır: iyonik, ortak değerlikli, ara durumlu. iyonik nitrürler N3" iyonu içerir. Bu türler arasında Li3N, Na3N (patlayıcı), Ca3N2 gibi alkali ya da toprak alkali nitrürler sayılabilir. Bu bileşikler hidrolizlendiğinde hidroksit ve amonyak verir. Ortak değerlikli nitrürlere örnek olarak, alüminyum nitrür (AIN) ile grafit yapısındaki bor nitrür (BN) gösterilebilir. Bor nitrür, hem cam döküm kalıplarına camın yapışmasını önler, hem de potalarda astar olarak kullanılır; çünkü erimiş demir bor nitrürü ıslatmaz. Ara durumlu nitrürler, geçiş metalleriyle oluşur ve örnek olarak Fe4N, Mn4N verilebilir. Sert olarak bu bileşiklerin erime noktaları yüksektir; iyi İletkendirler ve görünümleri metallere benzer.
Azot oksitleri
Bu bileşiklerin sayısı oldukça kabarıktır: diazot monoksit ya da azot hemioksit (N20), azot monoksit (NO), diazot trioksit ya da nitrit anhidrit ya da azot seskioksit (N203), azot dioksit ya da diazot tetraoksit (N02)ve diazot pent-oksit ya da nitrik anhidrit (N2Og). Bütün bu oksitler elementlerinden elde edildiklerinde ısı alıcıdır; bu nedenle orta sıcaklıkta az kararlıdırlar. Bozunmaları sırasında oksijen verdiklerinden yükseltgen rolü oynayabilirler; örneğin hepsi tutuşturulmuş kömürün tümüyle yanmasını sağlayabilir. Hidrojen, azot oksitlerini indirgeyerek azot ve su verir; bu tepkime platin süngeri katalizörlüğünde gerçekleştirilirse amonyak oluşur.
Bütün bu bileşikler arasında yalnızca azot monoksit, kendi elementlerinden doğrudan doğruya elde edilebilir.
1. Diazot monoksit. Azot oksidül ya da azot protoksit (N20) 1776'da Priestley tarafından bulundu. Renksiz ve kokusuz bir gazdır; havaya göre yoğunluğu 1,53'tür; sıvılaştırılması çok kolaydır ve -89°C'ta kaynar; ayrıca suda oldukça çok çözünür (0°C'tabir litre suda bir litre diazot monoksit)
Solunum yoluyla alındığında önce beyinde bir gülme uyarısına yol açar; bu nedenle Davy bu oksite "güldürücü gaz" adını vermiştir. Güldürme etkisinin ardından anestezik etkileri görülür ve özelliği kimi cerrahi işlemlerde kullanımını sağlar. Isı etkisiyle kolayca bozunarak elementlerini açığa çıkarır. Akkor bir cismin dokunuşuyla başlayan bu bozunma üçte bir oranında oksijen içeren bir azot ve oksijen karışımı verir; dolayısıyla kükürt, fosfor, karbon, magnezyum gibi yanıcı maddeler tutuşturularak daldırılırsa bu gaz içinde de canlı bir parlaklıkla yanmalarını sürdürürler. Azot protoksit, bir noktasından için için yanan bir tahta parçasını yeniden alevlendirir; ancak oksijenden farklı olarak yavaş yanmayı sürdürmez ve soğukta beyaz fosforca soğurulmaz; ayrıca azot monoksitle kırmızı duman vermez.
Azot protoksit piyasada çelik tüpler içinde sıvı olarak satılır, atom soğurma spektrofotometrisinde yakıcı gaz olarak kullanılır. Asetilenazot protoksit karışımı yaklaşık 3000°C sıcaklıkta bir alev verir ve ateşe dayanıklı oksitlerdeki elementlerin (Al, Ti) miktarını belirtmeye yarar.
2. Azot monoksit. 1772'de Hales ve Priestley buldu; kokusu belirsiz, renksiz bir gazdır; havada tutulduğunda azot dlok-side (N02) dönüşür. Yoğunluğu 1,04 olan azot monoksidin sıvılaştırılması zordur (kaynama noktası -150°C); suda çok az çözünür. Soğukta kararlı değildir; kızıl derecede tümüyle bozunur. Bu nedenle yakıcı özellikler taşır; ama cisimlerin azot monoksitle yanabilmesi için daha yüksek bir sıcaklığa değin ısıtılması gerekir. Nitekim, kibrit, azot monoksit içinde söner. Oksijenle temas ederse yükseltgenerek nitrit anhidrit ve azot dioksit verir. Tersinir bir tepkimeyle oluşan yükseltgenme ürünlerinin oranları, oksijen miktarına ve sıcaklığa bağlıdır. Nitrit anhidrit ancak soğukta elde edilebilir.
Bu özelliği nedeniyle azot monoksit indirgen bir gazdır: Potasyum permanganat, derişik nitrik asit vb. ile tepkimeye girer. Halojenlerle tepkimesi nitrozil halojenürleri oluşturur. Isı veren bu tepkime,
40°C dolayında klor ile'etkin alümin eşliğinde gerçekleştirilir ve aşağıdaki denklemle gösterilir:
2NO+CI a 2N0CI.
Sanayide, elementlerinin elektrik arkında doğrudan bireşimi yoluyla ya da amonyağın katalitik yükseltgenmesiyle elde edilir; ama oluşumunun hemen ardından nitrik ya da nitrit aside dönüşür.
3. Azot dioksit. Azot dioksit,-10°C'ta renksiz kristaller halinde katılaşır. 0°C'a doğru, uçuk sarı renkli bir sıvıya dönüşür; ama sıcaklık arttıkça kırmızı duman çıkararak daha koyu bir renge bürünür. 21 °C'ta kaynar. Isıtıldıkça dumanı daha da koyulaşır ve saydamlığını yitirerek opaklaşır. Aynı zamanda yoğunluğu da giderek azalır. Bu belirgin nitelikleri iki ayrı molekül türünün varlığıyla açıklanır: dimer (N2O4), renksiz ve soğukta kararlıdır; monomer (NO2) oldukça renklidir; sıcakta tersinir tepkime monomer oluşumu yönünde gerçekleşir: N204 e 2N02. 130°C'ta tam bir ayrışma doğar.
180°C ile 600°C arasında N02 molekülü azot monoksit vererek ayrışır:
N02 = NO + l-02.
Bu tepkimeden azot dioksidin yakıcı ve yükseltgen özeliklerinin azot monokside göre daha belirgin olduğu anlaşılır. Bu bileşik uçucu ve yanıcı bir sıvıyla (benzin, karbon sülfür) karıştırılırsa, panklastitler denen şiddetli patlayıcıları oluşturur. Ayrıca uzay roketlerinde ergol olarak kullanılır. Suya karşı karma bir anhidrit gibi davranır; 0°C'ta nitrit asit ve nitrik asidin bir karışımı elde edilir: 2N02 + H20 ->HN02 + HN03. Alkali çözeltiyle nitrit ve nitrat oluşturur. Azot dioksit olağan sıcaklıkta su ile tepkimeye girerse, nitrit asit bu sıcaklıkta bozunacağından, tersinir bir tepkime uyarınca nitrik asit ve azot monoksit ortaya çıkar:
3N02 + H20 = 2HNO3 + NO.
Sanayi alanında nitrik asidin bireşiminde bu tepkimeye başvurulur. Ayrıca azot dioksit, bazen azotil gibi bir değerli kök rolü oynar.
4. Nitrit anhidrit 5. Nitrik anhidrit
Hidrojenli bileşikler
- AMONYAK, AZOTÜR asit,
- HİDRAZİN.
- Oksijenli asitler
- HİPONİTRİT, NİTRİT. NİTRİK
Halojenli bileşikler. Çok karmaşık brom ve iyot bileşikleri dışında bilinen bileşikler azot klorür (NCI3) ve fluorürlerdir (NF3). Azot fluorür, oldukça kararlı bir gazdır; azot klorür ise çok duyarlı, sıvı bir patlayıcıdır.
Gaz ve sıvı azot. Gaz azot, hem bireşim etkeni (amonyak üretimi), hem de yansız gaz olma özellikleri nedeniyle ge ıiş bir kullanım alanı bulur. (Yansız atmosfer oluşturma, yangınlara karşı korunma, temizleme gazı olarak yararlanma vb.) Sıvı haldeki azotun ise soğutucu sıvı olarak (olağan kaynama noktası 77,3 K, yaklaşık -196°C) pek çok uygulama alanı vardır ve örnek olarak şunları verebiliriz: besin sanayisi alanındaki uygulamaları (besin maddelerinin hızla dondurulması, çabuk çürüyen besin maddelerini taşıyan araçların soğutulması); tıptaki uygulamaları (yapay döllenme için spermanın saklanması, doku ve organ bankaları, cerrahi kriyosondaların soğutulması, deri hastalıklarının soğukla tedavisi, özellikle küçük deri urlarının yok edilmesi, siğiller); sanayi alanındaki uygulamaları (soğuk pompalama, uzay benzeşim odaları, kararsız sollerin dondurulması, soğukta çapak alma, soğuk öğütme, çeşitli maddelerin geri kazanımı). Sıvı azot, binlerce metreküplük depolarda stoklanır ve onlarca metreküplük tankerlerle taşınır.
Biyokim. Kanda hem proteik azot (pep-titlerin ve proteinlerin azotu), hem proteik olmayan azot (üre, amonyak, aminoasitler, ürik asit) bulunur. Proteinlerin tümü %16 azot içerir. Polipeptit azotu böbrek ve karaciğer hastalıklarında artar ve bunun değişimleri, ürenin değişimlerinden daha iyi bir şekilde hastalığın gidişini gösterir. Azot vücuttan idrarla atılır; atılma daha çok üre (% 82), amonyak, aminoasit, ürik asit ve kreatinin biçiminde olur. Azotun vücutta tutulması büyüme gereksinimi bakımjndan çocukta ve gebe kadında daha belirgindir.
Çevrebil ve Tarım. Son derece karmaşıklığına karşın, azot dolaşımı biyosferin en iyi bilinen büyük madde dolaşımlarından biridir.
Canlı maddedeki azot, özellikle proteinler, atmosferdeki azottan gelir, çeşitli süreçler sonucunda organik bileşiklerin yapısına girer. Tutma, bağlama denen bu ilk aşamayı amonyaklaşma' ve nitratlaşma izler; böylece nitrit ve nitrat biçiminde mineralleşen bu azotlu bileşikler doğrudan doğruya bitkilerce soğurulabilir. Eğer nitrat" bozma süreci olmasaydı, bir başka deyişle, tutulmuş olan azotun bir kısmı nitrat bozma süreciyle atmosfere geri dönmeseydi bu dolaşım tamamlanamazdı.
Havadaki azotun tutulması çeşitli biçimde olabilir; azotun en büyük bölümünü toprağa çekip alan etmen mikroorganizmalardır. Bunların en İyi bilinen ve en bol olanları arasında topraktaki serbest ve aerobi bakteriler (azotobacter) ya da anaerobi bakteriler (Clostridium) bazı mavisuyosunları (nostoc, anaboena) ve baklagillerdeki ortakyaşar bakterilerdir. Bu sonuncular çok önemlidir, çünkü toprağa en çok azotu bunlar sağlar; örneğin bir yonca tarlasında toprağa giren azot miktarı yılda hektar başına 400 kg'ı bulur. Bugünkü durumda önem sırası açısından, ikinci sırayı sanayi gübrelerindeki azot alır; onun ardından daha az oranda olmak üzere, elektrokimyasal (gökgürültülü sağnaklar) ve fotokimyasal süreçler gelir. Bu yollarla değişikliğe uğrayan azot genellikle nitrat biçiminde girerek, üstün yapılı bitkilerce proteinlerin sentezinde kullanılır.
Topraktaki azotun % 95'ten fazlası durağan humusta yer alır ve mineral maddelere çok sıkı bağlandığından mikroorganizmaların eyleminden çok az etkilenir. Bir başka organik bölük, ölü ya da canlı mikroorganizmalar ve kimilerince "geçici ürünler" diye adlandırılan, çözülme ya da bireşme yolundaki basit metabolitler gibi değişken organik maddelerdir. Son olarak, organik azot, henüz değişime uğramamış olan taze bitkisel ve hayvansal artıklarda bulunur.
Proteinlerin aminoasitlere parçalanmasından (proteoliz) sonra yer alan amonyaklaşma sonucunda aminoasitlerden amonyak biçiminde azot ortaya çıkar. Bunu da en başta bakteriler ve mantarlar yapar.
Amonyak biçimindeki azot bitkilerce soğurulabilir, ama amonyak aynı zamanda dışbeslek (heterotrof) mikroorganizmalar için de aranan bir besindir. Amonyak-sal azot topraktaki emici mekanizma ile alıkonur ve sularla akıp gitmesi önlenir. Bazı killi topraklarda (iliit) bir geri dönüş sürecine de uğrayabilir.
Nitratlaşma amonyağın nitrata yükseltgenmesidir. Bunu iki tip bakteri sağlar: nitrosomonas denen bakteriler amonyağı nitrite dönüştürür; nitrobacter denenlerse bu bileşiği yükseltgeyerek bitkilerce soğurulabilir nitrat haline getirir.
Nitrat bozma en başta, nitratları gaz halinde azota ve oksijene ayıran nitratsızlaştırıcı bakterilerin etkisiyle gerçekleşir.
Nitratlı azot uçucu bir nesnedir, toprakta çok ender birikir. Ama nitratlaşma sürecinin de zorunlu bir aşamasıdır. Bununla birlikte nitritler, iyi havalanmamış topraklarda önemli miktarda birikebilir; o zaman nitrat bozma süreçleri yoğunlaşır. Nitrik azot ise azotun mineralleşmesirıin son ürünüdür. Görülebilen nitrik azot miktarı, birlikte yürüyen iki etkinliğin sonucudur:
Bir yandan, mineralleşme organik azotu amonyaksai azota (amonyaklaşma), sonra nitrik azota dönüştürür; öte yandan, mikroorganizmalar kendi bünyelerinde mineral azotu organik azota dönüştürürler (organikleşme).
Çevresel koşullara göre bu iki etkinlikten biri, bir süre öbürüne üstün gelebilir, ama değişiklik ters yönde de aynı hızla gerçekleşir, iyi koşullarda (elverişli nem, oldukça yüksek sıcaklık ve mayalandırıcı karbon yokluğu) mineralleşme organikleşmeye büyük ölçüde üstün gelir. Toprakta eriyik içinde bulunan kullanılabilir nitrik azot büyüme evresinde bitkilerce yüksek bir hızla soğurulur. O zaman topraktan çekilen azot hektar başına günde 3 kg dolayındadır. Bununla birlikte o sırada kök soğurmasına bağlanamayan bir miktar azot kaybı daha olabilir. Bu olgu azotun rizosfer (kökküre) bölgesinde yeni bir düzenlemeye geçmesinden ileri gelir. Eğer mineralleşme koşulları elverişliyse genellikle hasattan az bir zaman sonra bu olay kaybolur.Topra-ğa azotlu gübre vermenin amacı, toprağın verebileceği azotu tamamlamak olmalıdır; bunun nedeni topraktaki azotun yetersiz kalıp bitkinin büyümesini sınırlayıcı bir etmen olmaması, bir başka nedeni de sularla akıp giden azot kaybını elden geldiğince azaltmaktır.
Gerçekten de azot, nitratların ya da suda eriyen organik maddelerin toprağı yıkayan sularla akarsulara ve okyanuslara sürüklenmesi sonucunda dolaşımdan çıkabilir. Bu durumda azot biyolojik bağlarla tutulma ve nitrat bozma yoluyla yeniden dolaşıma sokulabilir; sonunda ya atmosfere yollanır ya da derinlerde tortular içinde birikir.
Nitrat bozma süreçlerine karşın, bugünkü durumda, bazı akarsularda ve derindeki sulu katmanlarda tutulan azot miktarında bir artış görülmektedir. (Bu olgu insan sağlığı için tehlikeli sonuçlar doğurabilir: zehirli nitrit yüklü sular, göllerin oksijensizleşmesi, vb.)
Zootekn. Evcil hayvanların rasyonlarında, genetik potansiyellerinin onlara sağladığı üretim düzeyini tutturabilecek miktarda azot bulunmalıdır Her hayvan türü için azot gereksinimleri deneylerle saptanmış normlara göre hesaplanır. Besinler azotu değişik biçimlerde içerir: protit azotu (aminoasitlerde yer alan azot), proteik azot (besinlerin çözünmeyen azotlu kısımları), proteik olmayan azot (ya da çözünür azot). Bu azot bir öncekinin bütünleyici kısmını oluşturur ve protitler dışı azotlarla aminoasitleri ve küçük peptitleri içerir.
MsXLabs.org & Büyük Larousse

 Elementler - Azot
Elementler - Azot



