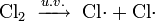Radikal Kimyası
MsXLabs.org & Vikipedi, özgür ansiklopedi
Tarihsel olarak radikal terimi bir moleküle ekli olan ve kimyasal tepkimede değişmeyen kısımları için kullanılırdı. Günümüzde bunlar için fonksiyonel grup terimi kullanılmaktadır. Örneğin, metil alkolün bir metil radikali ve bir hidroksil radikalinden oluştuğu söylenirdi. Modern kimyada anlaşıldığı şekliyle bunlar radikal değildir çünkü birbirlerine kovalent olarak bağlıdırlar ve eşleşmemiş reaktif elektronları yoktur. Ancak, eğer metil alkol yüksek enerjili elektronlar ile parçalanırsa, kütle spektrometrisi ile metil ve hidroksil radikallerinin meydana geldiği görülebilir.
Kimyasal tepkimelerde radikallerin belirtilmesi
Kimyasal denklemleri yazarken serbest radikaller genelde atom sembolü veya moleküler formülün sağ üstüne bir nokta koyarak belirtilir:
Kimyada, serbest radikaller radikal eklemesi ve radikal substitusyonunda reaktif araürün olarak yer alırlar.
Serbest radikaller içeren zincirleme tepkimeler genelde üç ayrı sürece ayrılırlar:
1. Başlama
2. Yayılma
3. Sonlanma
Ancak, yayılma aşaması çok ekzotermiktir. Çoğu radikal türü yüksüz olmakla beraber radikal iyonlar mevcuttur.
Radikaller ayrıca bir atom veya molekülün tek elektronlu yükseltgenme veya indirgenmesi ile oluşabilir. Bunun bir örneği, elektron taşıma zinciri tarafından süperoksit oluşmasıdır. Organometalik kimyada yapılan ilk araştırmalar, özellikle F.A. Paneth ve K. Hahnfeld'ın 1930'lardaki çalışmaları, bağların heterolitik fisyonunu ve bunun mekanizmasının radikal temelli olduğunu göstermiştir.
Kalıcılık ve stabilite
Uzun ömürlü radikaller iki kategoriye ayrılırlar:
1. Kararlı radikaller
Kararlı radikalin en iyi örneği moleküler dioksijen O2'dir. Organik radikaller eğer konjüge π systemi içinde yer alırlarsa uzun ömürlü olabilirler, α-tokoferol (E vitamini) türevi radikalde olduğu gibi. Tiazil radikallerinin yüzlerce bilinen örneği dikkate değer derecede kinetik ve termodinamik stabilite göstermesine karşın ve çok sınırlı derecede π rezonans stabilizasyonu gösterir.
2. Kalıcı radikaller
Kalıcı (persistent) radikal bileşiklerin uzun ömürlülüğünün nedeni, radikal merkez etrafındaki sterik kalabalıktır, bu yüzden radikalin başka bir molekülle tepkimesi zordur. Bunun örnekleri Gomberg'in trifenil radikali, Fremy'nin tuzu (Potasyum nitrosodisülfonat, (KSO3)2NO·), nitroksitler (genel formül R2NO·; örneğin TEMPO, verdazil'ler, nitronil nitroksitler, azefenilenil'ler), perklorofenylmetil radikal türevleri ve tris(2,4,6)-triklorofenylmetil radikali). En uzun ömürlü serbest radikal melanin'dir, milyonlarca yıl sürebilir. Kalıcı radikaller yanma sırasında büyük miktarda oluşurlar. Yanma sonucu havaya yayılan mikroskopik taneciklerin bu yolla meydana getirdiği oksidatif stresin kardiopülmoner hastalıklara ve muhtemelen kansere neden olabileceği önerilmiştir.
Diradikal
Diradikaller iki radikal merkezli moleküllerdir. Bir molekülde birden çok radikal merkezi bulunabilir. Moleküler oksijen doğal olarak (örneğin atmosferdeki oksijen olarak) bir diradikal olarak bulunmaktadır (taban durumunda triplet oksijen olarak). Atmosferik oksijenin yüksek reaktivitesi kısmen onun diradikal halinden kaynaklanmaktadır (gerçi dioksijenin radikal olmayan halleri aslında daha az kararlıdır). Atmosferik oksijenin triplet-halli gerçek bir radikal olması onun paramanyetik karakterine neden olur, bu da kolaylıkla gösterilebilir, örneğin oksijenin bir mıknatıs tarafından çekilmesiyle. (Ancak paramanyetizma radikal olmayı gerektirmez).
Reaktivite
Radikal alkil ara ürünlerin stabilizasyonu için kıstaslar karbokatyonların kıstaslarına benzer: serbest radikal merkez ne kadar substitüe ise o kadar daha kararlıdır. Bu özellik, tepkimelerini etkiler: üçüncül radikal (R3C·) oluşumu ikincil (R2HC·) veya birincil (RH2C·) radikal oluşumundan daha tercihlidir. Ancak, fonksiyonel grupların yanındaki radikaller (karbonil, nitril ve eter gibi) tertiyer (üçüncül) alkil radikallerden daha kararlıdır. Radikaller çift bağlara saldırır, ama benzeri iyonlardan farklı olarak, elektrostatik etkileşimlerden fazla etkilenmezler. Örneğin, nükleofilik iyonların α,β-doymamış bileşiklerle (C=C-C=O) olan raktivitesi, oksijenin elektron çekici etkisi tarafından yönlenir, bunun sonucu olarak karbonil karbonu üzerinde kısmî bir artı yük oluşur. İyonik durumda iki reaksiyon gözlemlenir: karbonil grubuna saldırı sonucu karbonile doğrudan bir ekleme olur, veya konjüge ekleme yoluyla vinil grubuna saldırı olur, ve her iki durumda da nükleofil üzerindeki yük oksijen tarafından alınır. Radikaller çift bağa hızla eklenirler ve meydana gelen α-radikal karbonil göreli olarak kararlıdır; başka bir molekülle birleşebilir veya oksitlenebilir. Buna rağmen, radikallerin elektrofilik/nötrofilik karakteri çeşitli şartlarda gösterilmiştir (örneğin, maleik anhidrit (elektrofilik) ve stirenin (az nükleofilik) kopolimerizasyonundaki dönüşüm eğilimi)
İntramoleküler tepkimelerde, radikalin aşırı reaktivitesine rağmen ince kontrol mümkündür. Radikaller en yakın reaktif konuma en kolaylıkla saldırır. Dolayısıyla, seçenek olan durumlarda, 5 üyeli halkalar en tercihli ürün olur: dört üyeli halkalar fazla gergindir, zincir üzerinde aralarında dörtten fazla atom olan karbonlar ise birbirleriyle ender çarpışır.
Yanma
Çoğu kişi için en iyi bilinen serbest radikal tepkimesi yanmadır. Oksijen molekülü kararlı bir diradikaldir, bunun en iyi gösterimi ·O-O· şeklindedir, bu molekülün kararlı olmasının nedeni elektronlarının spinlerinin paralel olmasıdır. Oksijenin taban durumunda spinleri eşleşmemiş (triplet) diradikaldir ama son derece reaktif, spin eşlenmiş (singlet) bir hâli de mevcuttur. Yanmanın olabilmesi için bu iki hâl arasındaki enerji bariyerinin aşılması gereklidir. Isı sayesinde bu bariyer aşılabilir ama bu yüksek sıcaklık gerektirir. Bu bariyer enzimler tarafından aşağıya çekilebilir, bu sayede canlıların içindeki sıcaklıklarda bu tepkimeler gerçekleşebilir.
Yanma, singlet radikalin başlatabildiği çeşitli radikal zincirleme reaksiyonlarından oluşur. Belli bir maddenin yanabilirliği, bu zincirleme reaksiyonun başlama ve yayılma aşamalarında yeterince serbest radikal olmasına bağlıdır. Yanabilir madde yanıp bittikten sonra sonlanma reaksiyonları baskın gelir ve alev söner. Yayılma ve sonlanma tepkimelerine etki ederek yanabilirliği değiştirmek mümkündür. Tetraetil kurşun bir zamanlar benzine eklenirdi çünkü kurşun, benzin-hava karışımındaki serbest radikalleri etkinsizleştirir. Bu sayede yanmanın kontrolsuz bir şekilde başlaması (motor vuruntusu) veya prematür yanma (önyanma) engellenir.
Bir hidrokarbon yanarken, çok sayıda farklı oksijen radikalleri tepkimede yer alır. İlk oluşan bir hidroperoksit radikalidir (HOO·), bu hidroperoksitlere dönüşür, bunlar da hidroksit radikallerine parçalanır.
Polimerleşme
Yanmanın yanı sıra, çoğu polimerizasyon reaksiyonu serbest radikaller içerir. Bunun sonucu çoğu plastik, emay ve diğer polimerler radikal polimerizasyonu aracılığıyla meydana gelir.
Radikal polimerizasyon yöntemlerinde yeni yöntemler arasında:
Atmosferik radikaller
Aşağı atmosferde en yaygın radikal moleküler dioksijendir. Diğer serbest radikaller, fotoayrışma sonucu meydana gelir. Fotoayrışmanın en önemli örneği azot dioksitin fotoayrışması sonucu bir oksijen atomu ve azot oksit oluşmasıdır; bu tepkime "smog" (dumanlı sis) oluşumunun altında yatar. Bir diğer önemli tepkime, ozonun fotoayrışması sonucu uyarık oksijen atomu O (1D) meydana gelmesidir. Üst atmostferde radikallerin önemli bir kaynağı, normalde reaktif olmayan kloroflürokarbonların güneş morötesi ışınları tarafından fotoayrışıma uğraması veya diğer stratosfer bileşenleri ile tepkimeye girmesidir. Bu serbest radikaller sonra katalitik bir zincir tepkime ile ozonla tepkirler ve ozon kaybına neden olurlar. Bu tepkimede serbest radikaller yeniden oluşur ve yeni reaksiyonlara katılabilirler. Bu reaksiyonların ozon tabakasının yok olmasının birincil nedeni olduğuna inanılmaktadır, bu yüzden kloroflürokarbonların soğutucu olarak kullanılması kısıtlanmıştır.
Biyolojide serbest radikaller
Serbest radikaller bazı biyolojik süreçlerde önemli bir rol oynar, bunların bazıları yaşam için gereklidir, örneğin nötrofil granülositler tarafından bakterilerin hücre içinde öldürülmesi. Serbest radikaller bazı hücre sinyalizasyon süreçlerinde yer aldıkları gösterilmiştir. Buna redoks sinyalizasyonu adı verilmiştir.
Oksijenli serbest radikallerin en önemlileri süperoksit ve hidroksil radikalidir. İndirgeyici şartlarda moleküler oksijenden meydana gelirler. Ancak, reaktif ozelliklerinden dolayı, bu serbest radikaller hücre hasarına neden olan yan reaksiyonlara girerler. Çoğu kanser tipinin serbest radikaller ve DNA arasındaki reaksiyonların sonucu oluştuğu, bunun sonucu olarak mutasyonların meydana geldiği ve bunların hücre döngüsüne olumsuz etki ettiği ve potansiyel olarak kötücüllüğe yol açtığı düşünülmektedir. Yaşlanmanın bazı belirtileri (ateroskleroz gibi) vücudu oluşturan kimyasalların serbest radikaller tarafından oksidasyonuna atfedilir. Buna ilaveten, serbest radikaller alkole bağlı karaciğer hasarına katkıda bulunur. Sigara dumanındaki radikallerin akciğerde bulunan alfa-1 antitripsini inaktive ettiğine dair bulgular vardır. Bu süreç amfizem oluşumunu hızlandırır.
Serbest radikallerin rol oynadığı düşünülen diğer hastalıklar arasında Parkinson hastalığı, yaşlılık ve ilaç nedenli sağırlık, Şizofreni ve Alzheimer Hastalığı da bulunmaktadır. Demir depo hastalığı hemokromatoz, klasik bir serbest radikal sendromudur, serbest radikallerle ilişkilendirilmiş olan bir belirtiler kümesi ile beraber görülür: hareket bozukluğu, psikoz, deri pigmenti melanin bozuklukları, sağırlık, atrit ve diyabetes mellitus gibi. Yaşlanmanın serbest radikal teorisine göre yaşlanma sürecinin altında serbest radikaller yatar, buna karşın mitohomesis süreci serbest radikallere mağruz kalmanın yaşam süresini uzatabileceğini düşündürmektedir.
Serbest radikaller yaşam için gerekli olduğu için, serbest radikallerin neden olduğu hasarı en aza indirmek ve meydana gelen hasarı onarmak için vücudun çeşitli mekanizmaları bulunmaktadır. Bunlar arasında süperoksit dismutaz, katalaz, glutatyon peroksidaz ve glutatyon redüktaz enzimleri sayılabilir. Bunlara ek olarak, antioksidanlar bu savunma mekanizmalarında önemli rol oynar. Bunlar başlıca A vitamini, C vitamini, E vitamini ve polifenol antioksidanlarıdır. Ayrıca, bilirubin ve ürik asit de bazı serbest radikalleri nötralize ederek antioksidan gibi etkiyebilir. Bilirübin hemoglobinin yıkımından meydana gelir, ürik asit ise pürin türevlerinin yıkımından oluşur. Aşırı miktarda bilirubin sarılığa neden olabilir, bu da merkezî sinir sistemine zarar verebilir. Aşırı ürik asit ise gut hastalığına neden olur.
Reaktif oksijen türleri
Reaktif oksijen türleri, süperoksit, hidrojen peroksit ve hidroksil radikali gibi moleküllerdir ve hücre hasarı ile ilişkilendirilmişlerdir. Reaktif oksijen türleri oksijenin normal metabolizmasının bir yan ürünü olarak oluşurlar ve hücre sinyalizasyonunda önemli rol oynarlar.
Radikallerin gevşek tanımı
Çoğu kimya dalında, radikalllerin tarihsel tanımı moleküllerin sıfır olmayan bir spine sahip olduğunu iddia eder. Ancak, spektroskopi, kimyasal tepkime ve astrokimya gibi dallardaki tanım biraz farklıdır. Radikallerin elektronik yapısı ve geometrisi üzerine araştırması için Nobel ödülünü kazanan Gerhard Herzberg, serbest radikaller için biraz daha gevşek bir tanım önermiştir: "Kimyasal olarak kararsız herhangi bir kısa ömürlü tür (atom, molekül veya iyon)." Önerisinin ana teması, sıfır spinli pekçok kimyasal olarak kararsız molekül vardır, C2, C3, CH2 ve benzerleri gibi. Geçici kimyasal süreçler ve astrokimyasal süreçlerin değerlendirilmesinde bu tanım daha kullanışlıdır. Dolayısıyla bu sahalardaki araştırmacılar bu gevşek tanımı tercih etmektedirler.
Ölçüm
Serbest radikal ölçüm teknikleri arasında aşağıdakiler bulunmaktadır:
MsXLabs.org & Vikipedi, özgür ansiklopedi
Sponsorlu Bağlantılar
Moses Gomberg (1866-1947), radikal kimyasının kurucusuKimyada radikaller (çoğu zaman serbest radikal olarak değinilir) eşleşmemiş elektronu olan atom, molekül veya iyonlardır. Bu eşleşmemiş elektronlar genelde son derece reaktiftir. Radikaller, yanma, atmosfer kimyası, polimerleşme, plazma kimyası, biyokimya ve pekçok başka kimyasal süreçte önemli rol oynar. Örneğin, insan fizyolojisinde, süperoksit ve azot oksit, damar tonusu gibi pekçok biyolojik süreci düzenler. Radikal ve serbest radikal terimleri genelde eşanlamlı kullanılmakla beraber, bir radikal bir çözelti kafesi içinde hapsolmuş veya başka bir moleküle bağlanmış durumda olabilir. 1900'de Michigan Ünivesitesi'nde Moses Gomberg tarafından betimlenen trifenilmetil radikali, ilk tespit edilmiş organik serbest radikal olmuştur.
Tarihsel olarak radikal terimi bir moleküle ekli olan ve kimyasal tepkimede değişmeyen kısımları için kullanılırdı. Günümüzde bunlar için fonksiyonel grup terimi kullanılmaktadır. Örneğin, metil alkolün bir metil radikali ve bir hidroksil radikalinden oluştuğu söylenirdi. Modern kimyada anlaşıldığı şekliyle bunlar radikal değildir çünkü birbirlerine kovalent olarak bağlıdırlar ve eşleşmemiş reaktif elektronları yoktur. Ancak, eğer metil alkol yüksek enerjili elektronlar ile parçalanırsa, kütle spektrometrisi ile metil ve hidroksil radikallerinin meydana geldiği görülebilir.
Kimyasal tepkimelerde radikallerin belirtilmesi
Kimyasal denklemleri yazarken serbest radikaller genelde atom sembolü veya moleküler formülün sağ üstüne bir nokta koyarak belirtilir:
Klor gazı morötesi tarafından parçalanarak atomik klor radikalleri oluşturur. Radikal reaksiyon mekanizmalarında tek elektronların hareketini göstermek için tek uçlu oklar kullanılır:
Kırılan bir bağın homolitik kesilmesi 'balık oltası' ok ile gösterilir, iki elektronun hareketini göstermek için kullanılan eğri oktan farklı tutmak için. Kopan bağın ikinci elektronu da hareket eder ve saldıran radikal elektronu ile eşleşir; bu hareket özel olarak olarak gösterilmez.
Kimyada, serbest radikaller radikal eklemesi ve radikal substitusyonunda reaktif araürün olarak yer alırlar.
Serbest radikaller içeren zincirleme tepkimeler genelde üç ayrı sürece ayrılırlar:
1. Başlama
2. Yayılma
3. Sonlanma
- Başlama tepkimeleri, serbest radikal sayısında net bir artış olmasına neden olan tepkimelerdir. Bunlar, yukarıda gösterilen Tepkime 1'deki gibi, kararlı moleküllerden serbest radikallerin oluşması, veya serbest radikalin kararlı moleküllerle tepkiyerek daha çok serbest radikaller oluşturması olabilir.
- Yayılma tepkimeleri, serbest radikallerin yer aldığı ama serbest radikal sayısının değişmediği tepkimelerdir.
- Sonlanma tepkimeleri, serbest radikal sayısında net bir azalma olan tepkimelerdir. Tipik olarak iki serbest radikal birleşerek daha kararlı bir molekül oluştururlar, örneğin: 2Cl·→ Cl2
Ancak, yayılma aşaması çok ekzotermiktir. Çoğu radikal türü yüksüz olmakla beraber radikal iyonlar mevcuttur.
Radikaller ayrıca bir atom veya molekülün tek elektronlu yükseltgenme veya indirgenmesi ile oluşabilir. Bunun bir örneği, elektron taşıma zinciri tarafından süperoksit oluşmasıdır. Organometalik kimyada yapılan ilk araştırmalar, özellikle F.A. Paneth ve K. Hahnfeld'ın 1930'lardaki çalışmaları, bağların heterolitik fisyonunu ve bunun mekanizmasının radikal temelli olduğunu göstermiştir.
Kalıcılık ve stabilite
α-tokoferol'den türemiş radikal

Uzun ömürlü radikaller iki kategoriye ayrılırlar:
1. Kararlı radikaller
Kararlı radikalin en iyi örneği moleküler dioksijen O2'dir. Organik radikaller eğer konjüge π systemi içinde yer alırlarsa uzun ömürlü olabilirler, α-tokoferol (E vitamini) türevi radikalde olduğu gibi. Tiazil radikallerinin yüzlerce bilinen örneği dikkate değer derecede kinetik ve termodinamik stabilite göstermesine karşın ve çok sınırlı derecede π rezonans stabilizasyonu gösterir.
2. Kalıcı radikaller
Kalıcı (persistent) radikal bileşiklerin uzun ömürlülüğünün nedeni, radikal merkez etrafındaki sterik kalabalıktır, bu yüzden radikalin başka bir molekülle tepkimesi zordur. Bunun örnekleri Gomberg'in trifenil radikali, Fremy'nin tuzu (Potasyum nitrosodisülfonat, (KSO3)2NO·), nitroksitler (genel formül R2NO·; örneğin TEMPO, verdazil'ler, nitronil nitroksitler, azefenilenil'ler), perklorofenylmetil radikal türevleri ve tris(2,4,6)-triklorofenylmetil radikali). En uzun ömürlü serbest radikal melanin'dir, milyonlarca yıl sürebilir. Kalıcı radikaller yanma sırasında büyük miktarda oluşurlar. Yanma sonucu havaya yayılan mikroskopik taneciklerin bu yolla meydana getirdiği oksidatif stresin kardiopülmoner hastalıklara ve muhtemelen kansere neden olabileceği önerilmiştir.
Diradikal
Diradikaller iki radikal merkezli moleküllerdir. Bir molekülde birden çok radikal merkezi bulunabilir. Moleküler oksijen doğal olarak (örneğin atmosferdeki oksijen olarak) bir diradikal olarak bulunmaktadır (taban durumunda triplet oksijen olarak). Atmosferik oksijenin yüksek reaktivitesi kısmen onun diradikal halinden kaynaklanmaktadır (gerçi dioksijenin radikal olmayan halleri aslında daha az kararlıdır). Atmosferik oksijenin triplet-halli gerçek bir radikal olması onun paramanyetik karakterine neden olur, bu da kolaylıkla gösterilebilir, örneğin oksijenin bir mıknatıs tarafından çekilmesiyle. (Ancak paramanyetizma radikal olmayı gerektirmez).
Reaktivite
Radikal alkil ara ürünlerin stabilizasyonu için kıstaslar karbokatyonların kıstaslarına benzer: serbest radikal merkez ne kadar substitüe ise o kadar daha kararlıdır. Bu özellik, tepkimelerini etkiler: üçüncül radikal (R3C·) oluşumu ikincil (R2HC·) veya birincil (RH2C·) radikal oluşumundan daha tercihlidir. Ancak, fonksiyonel grupların yanındaki radikaller (karbonil, nitril ve eter gibi) tertiyer (üçüncül) alkil radikallerden daha kararlıdır. Radikaller çift bağlara saldırır, ama benzeri iyonlardan farklı olarak, elektrostatik etkileşimlerden fazla etkilenmezler. Örneğin, nükleofilik iyonların α,β-doymamış bileşiklerle (C=C-C=O) olan raktivitesi, oksijenin elektron çekici etkisi tarafından yönlenir, bunun sonucu olarak karbonil karbonu üzerinde kısmî bir artı yük oluşur. İyonik durumda iki reaksiyon gözlemlenir: karbonil grubuna saldırı sonucu karbonile doğrudan bir ekleme olur, veya konjüge ekleme yoluyla vinil grubuna saldırı olur, ve her iki durumda da nükleofil üzerindeki yük oksijen tarafından alınır. Radikaller çift bağa hızla eklenirler ve meydana gelen α-radikal karbonil göreli olarak kararlıdır; başka bir molekülle birleşebilir veya oksitlenebilir. Buna rağmen, radikallerin elektrofilik/nötrofilik karakteri çeşitli şartlarda gösterilmiştir (örneğin, maleik anhidrit (elektrofilik) ve stirenin (az nükleofilik) kopolimerizasyonundaki dönüşüm eğilimi)
İntramoleküler tepkimelerde, radikalin aşırı reaktivitesine rağmen ince kontrol mümkündür. Radikaller en yakın reaktif konuma en kolaylıkla saldırır. Dolayısıyla, seçenek olan durumlarda, 5 üyeli halkalar en tercihli ürün olur: dört üyeli halkalar fazla gergindir, zincir üzerinde aralarında dörtten fazla atom olan karbonlar ise birbirleriyle ender çarpışır.
Yanma
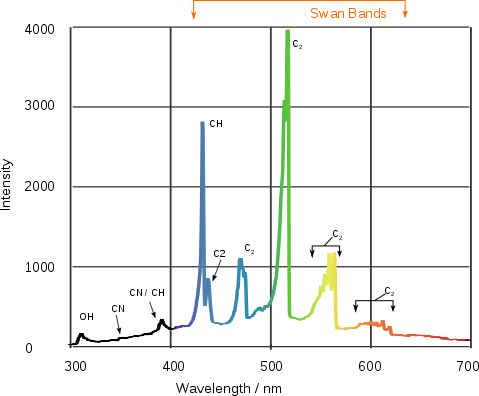
Bir butan alevinin spektrumu excited moleküler radikallerin emisyon bantaları ve Swan bantları.

Çoğu kişi için en iyi bilinen serbest radikal tepkimesi yanmadır. Oksijen molekülü kararlı bir diradikaldir, bunun en iyi gösterimi ·O-O· şeklindedir, bu molekülün kararlı olmasının nedeni elektronlarının spinlerinin paralel olmasıdır. Oksijenin taban durumunda spinleri eşleşmemiş (triplet) diradikaldir ama son derece reaktif, spin eşlenmiş (singlet) bir hâli de mevcuttur. Yanmanın olabilmesi için bu iki hâl arasındaki enerji bariyerinin aşılması gereklidir. Isı sayesinde bu bariyer aşılabilir ama bu yüksek sıcaklık gerektirir. Bu bariyer enzimler tarafından aşağıya çekilebilir, bu sayede canlıların içindeki sıcaklıklarda bu tepkimeler gerçekleşebilir.
Yanma, singlet radikalin başlatabildiği çeşitli radikal zincirleme reaksiyonlarından oluşur. Belli bir maddenin yanabilirliği, bu zincirleme reaksiyonun başlama ve yayılma aşamalarında yeterince serbest radikal olmasına bağlıdır. Yanabilir madde yanıp bittikten sonra sonlanma reaksiyonları baskın gelir ve alev söner. Yayılma ve sonlanma tepkimelerine etki ederek yanabilirliği değiştirmek mümkündür. Tetraetil kurşun bir zamanlar benzine eklenirdi çünkü kurşun, benzin-hava karışımındaki serbest radikalleri etkinsizleştirir. Bu sayede yanmanın kontrolsuz bir şekilde başlaması (motor vuruntusu) veya prematür yanma (önyanma) engellenir.
Bir hidrokarbon yanarken, çok sayıda farklı oksijen radikalleri tepkimede yer alır. İlk oluşan bir hidroperoksit radikalidir (HOO·), bu hidroperoksitlere dönüşür, bunlar da hidroksit radikallerine parçalanır.
Polimerleşme
Yanmanın yanı sıra, çoğu polimerizasyon reaksiyonu serbest radikaller içerir. Bunun sonucu çoğu plastik, emay ve diğer polimerler radikal polimerizasyonu aracılığıyla meydana gelir.
Radikal polimerizasyon yöntemlerinde yeni yöntemler arasında:
- Tersinir eklenme-parçalanma zincir transferi (Reversible Addition-Fragmentation chain Transfer; RAFT)
- Atom transfer radikal polimerizasyonu (Atom Transfer Radical Polymerization; ATRP)
- Nitroksit aracılıklı polimerizasyon (Nitroxide Mediated Radical Polymerization; NMP)
Atmosferik radikaller
Aşağı atmosferde en yaygın radikal moleküler dioksijendir. Diğer serbest radikaller, fotoayrışma sonucu meydana gelir. Fotoayrışmanın en önemli örneği azot dioksitin fotoayrışması sonucu bir oksijen atomu ve azot oksit oluşmasıdır; bu tepkime "smog" (dumanlı sis) oluşumunun altında yatar. Bir diğer önemli tepkime, ozonun fotoayrışması sonucu uyarık oksijen atomu O (1D) meydana gelmesidir. Üst atmostferde radikallerin önemli bir kaynağı, normalde reaktif olmayan kloroflürokarbonların güneş morötesi ışınları tarafından fotoayrışıma uğraması veya diğer stratosfer bileşenleri ile tepkimeye girmesidir. Bu serbest radikaller sonra katalitik bir zincir tepkime ile ozonla tepkirler ve ozon kaybına neden olurlar. Bu tepkimede serbest radikaller yeniden oluşur ve yeni reaksiyonlara katılabilirler. Bu reaksiyonların ozon tabakasının yok olmasının birincil nedeni olduğuna inanılmaktadır, bu yüzden kloroflürokarbonların soğutucu olarak kullanılması kısıtlanmıştır.
Biyolojide serbest radikaller
Serbest radikaller bazı biyolojik süreçlerde önemli bir rol oynar, bunların bazıları yaşam için gereklidir, örneğin nötrofil granülositler tarafından bakterilerin hücre içinde öldürülmesi. Serbest radikaller bazı hücre sinyalizasyon süreçlerinde yer aldıkları gösterilmiştir. Buna redoks sinyalizasyonu adı verilmiştir.
Oksijenli serbest radikallerin en önemlileri süperoksit ve hidroksil radikalidir. İndirgeyici şartlarda moleküler oksijenden meydana gelirler. Ancak, reaktif ozelliklerinden dolayı, bu serbest radikaller hücre hasarına neden olan yan reaksiyonlara girerler. Çoğu kanser tipinin serbest radikaller ve DNA arasındaki reaksiyonların sonucu oluştuğu, bunun sonucu olarak mutasyonların meydana geldiği ve bunların hücre döngüsüne olumsuz etki ettiği ve potansiyel olarak kötücüllüğe yol açtığı düşünülmektedir. Yaşlanmanın bazı belirtileri (ateroskleroz gibi) vücudu oluşturan kimyasalların serbest radikaller tarafından oksidasyonuna atfedilir. Buna ilaveten, serbest radikaller alkole bağlı karaciğer hasarına katkıda bulunur. Sigara dumanındaki radikallerin akciğerde bulunan alfa-1 antitripsini inaktive ettiğine dair bulgular vardır. Bu süreç amfizem oluşumunu hızlandırır.
Serbest radikallerin rol oynadığı düşünülen diğer hastalıklar arasında Parkinson hastalığı, yaşlılık ve ilaç nedenli sağırlık, Şizofreni ve Alzheimer Hastalığı da bulunmaktadır. Demir depo hastalığı hemokromatoz, klasik bir serbest radikal sendromudur, serbest radikallerle ilişkilendirilmiş olan bir belirtiler kümesi ile beraber görülür: hareket bozukluğu, psikoz, deri pigmenti melanin bozuklukları, sağırlık, atrit ve diyabetes mellitus gibi. Yaşlanmanın serbest radikal teorisine göre yaşlanma sürecinin altında serbest radikaller yatar, buna karşın mitohomesis süreci serbest radikallere mağruz kalmanın yaşam süresini uzatabileceğini düşündürmektedir.
Serbest radikaller yaşam için gerekli olduğu için, serbest radikallerin neden olduğu hasarı en aza indirmek ve meydana gelen hasarı onarmak için vücudun çeşitli mekanizmaları bulunmaktadır. Bunlar arasında süperoksit dismutaz, katalaz, glutatyon peroksidaz ve glutatyon redüktaz enzimleri sayılabilir. Bunlara ek olarak, antioksidanlar bu savunma mekanizmalarında önemli rol oynar. Bunlar başlıca A vitamini, C vitamini, E vitamini ve polifenol antioksidanlarıdır. Ayrıca, bilirubin ve ürik asit de bazı serbest radikalleri nötralize ederek antioksidan gibi etkiyebilir. Bilirübin hemoglobinin yıkımından meydana gelir, ürik asit ise pürin türevlerinin yıkımından oluşur. Aşırı miktarda bilirubin sarılığa neden olabilir, bu da merkezî sinir sistemine zarar verebilir. Aşırı ürik asit ise gut hastalığına neden olur.
Reaktif oksijen türleri
Reaktif oksijen türleri, süperoksit, hidrojen peroksit ve hidroksil radikali gibi moleküllerdir ve hücre hasarı ile ilişkilendirilmişlerdir. Reaktif oksijen türleri oksijenin normal metabolizmasının bir yan ürünü olarak oluşurlar ve hücre sinyalizasyonunda önemli rol oynarlar.
Radikallerin gevşek tanımı
Çoğu kimya dalında, radikalllerin tarihsel tanımı moleküllerin sıfır olmayan bir spine sahip olduğunu iddia eder. Ancak, spektroskopi, kimyasal tepkime ve astrokimya gibi dallardaki tanım biraz farklıdır. Radikallerin elektronik yapısı ve geometrisi üzerine araştırması için Nobel ödülünü kazanan Gerhard Herzberg, serbest radikaller için biraz daha gevşek bir tanım önermiştir: "Kimyasal olarak kararsız herhangi bir kısa ömürlü tür (atom, molekül veya iyon)." Önerisinin ana teması, sıfır spinli pekçok kimyasal olarak kararsız molekül vardır, C2, C3, CH2 ve benzerleri gibi. Geçici kimyasal süreçler ve astrokimyasal süreçlerin değerlendirilmesinde bu tanım daha kullanışlıdır. Dolayısıyla bu sahalardaki araştırmacılar bu gevşek tanımı tercih etmektedirler.
Ölçüm
Serbest radikal ölçüm teknikleri arasında aşağıdakiler bulunmaktadır:
- Elektron spin rezonans
- CIDNP adi verilen bir olgu kullanarak nükleer manyetik rezonans ile.
- Kimyasal işaretleme
- Serbest radikal işaretleri kullanarak
- Dolaylı yöntemler
- Antioksidan seviyeelerindeki azalmanın ölçülmesi (örneğin TAS, indirgenmiş glutatyon - GSH)
- Yakalayıcı ayıraçlar
Tanrı varsa eğer, ruhumu kutsasın... Ruhum varsa eğer!

 Kimyada Radikaller (Radikal Kimyası)
Kimyada Radikaller (Radikal Kimyası)