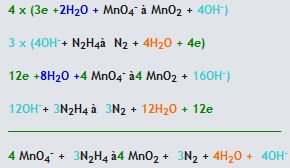Redoks
MsXLabs.org & MORPA Genel Kültür Ansiklopedisi
İçinde kimi atomların elektron vererek yükseltgenip kimi atomların da elektron alarak indirgendiği kimyasal tepkime. Bu tür tepkimelerde kimyasal denklem, alınan ve verilen elektron sayısının birbirine eşit olmasından yola çıkılarak denkleştirilir
Elektron transferi ile gerçekleşen bir reaksiyondur. Yükseltgenme olayı atomun elektron kaybetmesi ile veya oksidasyon sayısının artması ile gerçekleşirken indirgenme olayı ise atomun elektron kazanması ile veya oksidasyon sayısının azalması ile gerçekleşir. 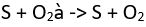 Yukarıdaki reaksiyonda kükürtün oksidasyon sayısı 0’dan +4’e yükselmiştir. Kükürt yükseltgenmiştir denir. Oksijenin ise oksidasyon sayısı 0’dan -2’ye azalmıştır (2 elektron kazanmıştır). Oksijen indirgenmiştir. Bu tür reaksiyonlarda bir atom kendi kendine indirgenemez veya yükseltgenemez. Yükseltegenen atom aynı zamanda indirgen ajan olarak bilinir. Tam tersine indirgenen atom aynı zamanda yükseltgen ajandır. Bu tür elektron alış verişi olan reaksiyonlara redoks tepkimeleri denir. Bu tür reaksiyonlarda hesap yapılabilmesi için öncelikle atomların veya bileşiklerin oksidayon sayılarının bilinmesi gerekmektedir. Genel olarak şu şekilde sınıflandırılabilir. 1. Elementel haldeki ( O2, Na, H2, P4) tüm atomların oksidasyon sayısı 0 dır 2. Basit iyonlarda oksidasyon sayısı iyonun sahip olduğu yüke eşittir (Cl- = -1, Na+ = +1) 3. Hidrojen bir çok reaksiyonda +1 oksidasyon sayısına sahiptir. 4. Oksijen içeren bileşiklerde oksijen genellikle -2 oksidasyon basamağına sahiptir. Fakat peroksit bileşiklerinde oksijen -1 oksidasyon basamağına sahiptir. 5. Flor -1 oksidasyon sayısına sahiptir. Yukarıdaki temel kurallar eşliğinde bileşiği oluşturan atomların oksidayon basamakları hesaplanabilir. Burada öncelikle bileğin toplam oksidasyon sayısına bakılmalıdır. Yani eğer yüksiz bir bileşikse toplam oksidasyon sayısı o’ dır. Veya (-) yüklü bir bileşikse toplam oksidasyon basamağı (-1) dir. K2CO3 yüksüz bir bileşik olduğu için toplam oksidasyon basamağı 0’ dır. Yani bileşiği oluşturan elementlerin elektronlarının toplamı 0 olmalıdır. Oksijenin -2 oksidasyon basamağına sahip olduğunu söylemiştik. Bileşikte 3 tane oksijen olduğundan ,oksijenden gelen elektron sayısı 3 x (-2)= -6 dır. K 1+ oksidasyon basamağına sahiptir. Potasyumdan gelen elektron sayısı 2 x (+1)= +2. Buradan karbonun oksidayon sayısını bulabiliriz. (-6) + (+2) + (x) = 0 x = +4 olmalıdır. HSO4- örneğinde ise bileşiğin toplam oksidasyon sayısı -1 dir . Hidrojenin oksidasyon basamağı +1, oksijenin oksidasyon basamağı (-2) x 4 = 8 Kükürtün oksidasyon basamağı bulunabilir. (+1) + (-8) + (x) = -1 x = +6 Eğer kükürt S2 şeklinde olsaydı o zaman (2x) demeliydik. Yukarıda bahsedilenleri bir örnek üzerinde uygulayabiliriz. Fe2O3 + 3CO
Yukarıdaki reaksiyonda kükürtün oksidasyon sayısı 0’dan +4’e yükselmiştir. Kükürt yükseltgenmiştir denir. Oksijenin ise oksidasyon sayısı 0’dan -2’ye azalmıştır (2 elektron kazanmıştır). Oksijen indirgenmiştir. Bu tür reaksiyonlarda bir atom kendi kendine indirgenemez veya yükseltgenemez. Yükseltegenen atom aynı zamanda indirgen ajan olarak bilinir. Tam tersine indirgenen atom aynı zamanda yükseltgen ajandır. Bu tür elektron alış verişi olan reaksiyonlara redoks tepkimeleri denir. Bu tür reaksiyonlarda hesap yapılabilmesi için öncelikle atomların veya bileşiklerin oksidayon sayılarının bilinmesi gerekmektedir. Genel olarak şu şekilde sınıflandırılabilir. 1. Elementel haldeki ( O2, Na, H2, P4) tüm atomların oksidasyon sayısı 0 dır 2. Basit iyonlarda oksidasyon sayısı iyonun sahip olduğu yüke eşittir (Cl- = -1, Na+ = +1) 3. Hidrojen bir çok reaksiyonda +1 oksidasyon sayısına sahiptir. 4. Oksijen içeren bileşiklerde oksijen genellikle -2 oksidasyon basamağına sahiptir. Fakat peroksit bileşiklerinde oksijen -1 oksidasyon basamağına sahiptir. 5. Flor -1 oksidasyon sayısına sahiptir. Yukarıdaki temel kurallar eşliğinde bileşiği oluşturan atomların oksidayon basamakları hesaplanabilir. Burada öncelikle bileğin toplam oksidasyon sayısına bakılmalıdır. Yani eğer yüksiz bir bileşikse toplam oksidasyon sayısı o’ dır. Veya (-) yüklü bir bileşikse toplam oksidasyon basamağı (-1) dir. K2CO3 yüksüz bir bileşik olduğu için toplam oksidasyon basamağı 0’ dır. Yani bileşiği oluşturan elementlerin elektronlarının toplamı 0 olmalıdır. Oksijenin -2 oksidasyon basamağına sahip olduğunu söylemiştik. Bileşikte 3 tane oksijen olduğundan ,oksijenden gelen elektron sayısı 3 x (-2)= -6 dır. K 1+ oksidasyon basamağına sahiptir. Potasyumdan gelen elektron sayısı 2 x (+1)= +2. Buradan karbonun oksidayon sayısını bulabiliriz. (-6) + (+2) + (x) = 0 x = +4 olmalıdır. HSO4- örneğinde ise bileşiğin toplam oksidasyon sayısı -1 dir . Hidrojenin oksidasyon basamağı +1, oksijenin oksidasyon basamağı (-2) x 4 = 8 Kükürtün oksidasyon basamağı bulunabilir. (+1) + (-8) + (x) = -1 x = +6 Eğer kükürt S2 şeklinde olsaydı o zaman (2x) demeliydik. Yukarıda bahsedilenleri bir örnek üzerinde uygulayabiliriz. Fe2O3 + 3CO à
2Fe + 3CO2 Fe2O3 bileşiğinde oksijenin oksidasyon sayısının -2 olduğunu ve bileşiğin toplam oksidayon sayısının 0 olduğunu biliyoruz 3 x (-2) + (2x)= 0
x= +3 (demirin oksidasyon basamağı)
Fe’ nin oksidasyon sayısı +3’den 0’ azalmış, yani elektron kaybetmiş, yani indirgenmiş, bu nedenlede yükseltgen ajan CO bileşiğindeki karbonun oksidasyon sayısı (-2) + (x) = 0 X= +2 (karbonun oksidasyon sayısı) CO2 bileşiğindeki karbonun oksidasyon sayısı 2 x (-2) + (x) = 0 X= +4 (karbonun oksidasyon sayısı)
C’ nin oksidasyon sayısı +2’den +4’ e yükselmiş , yani elektron kazanmış, yani yükseltgenmiş, bu nedenlede indirgen ajan. Reaksiyon Asidik çözeltide gerçekleşiyor ise
1.Öncelikle verilen reaksiyonun yarı basamak reaksiyonları yazılarak atomların gerekli stokiyometrik dengeleri sağlanır. 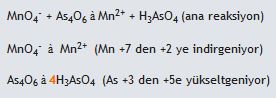 2. Reaksiyondaki Oksijen ve hidrojen dengeleri sağlanır.
2. Reaksiyondaki Oksijen ve hidrojen dengeleri sağlanır.- Eğer reaksiyon asidik ortamda oluşuyorsa her oksijen atomu için reaksiyonun karşı tarafına 1 H2O molekülü eklenir. Hidrojen dengesini sağlamak içinde su eklenen tarafın zıt tarafına gerektiği kadar H+ iyonu eklenir.
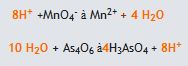 (reaksiyonun sağ tarafında 16 oksijen, sol tarafında 6 oksijen bulunmaktadır. Bu nedenle sol tarafa 10 H2O eklenmelidir) 3. Herbir ara reaksiyondaki, reaksiyonun sağında ve solundaki yükü eşitlemek için gerekli tarafa elektron eklenir.
(reaksiyonun sağ tarafında 16 oksijen, sol tarafında 6 oksijen bulunmaktadır. Bu nedenle sol tarafa 10 H2O eklenmelidir) 3. Herbir ara reaksiyondaki, reaksiyonun sağında ve solundaki yükü eşitlemek için gerekli tarafa elektron eklenir. 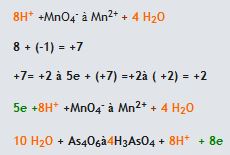 4.
4. İki yarı tepkimenin elektronlarını aynı yapıp yok edebilmek için gerekli katsayı ile çarpılır ve yarı tepkimelere taraf tarafa toplanır
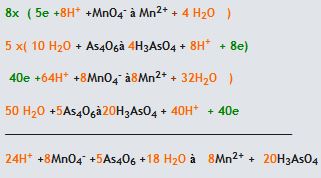
Reaksiyon Bazik Çözeltide Gerçekleşiyor ise
1. Öncelikle verilen reaksiyonun yarı basamak reaksiyonları yazılarak atomların gerekli stokiyometrik dengeleri sağlanır.
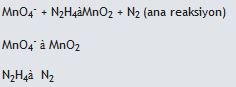
2. Reaksiyondaki Oksijen ve hidrojen dengeleri sağlanır.
- Eğer reaksiyon bazik ortamda oluşuyorsa ise her oksijen atomu için reaksiyonun karşı tarafına 1 H2O molekülü eklenir. Eklenen suda bulunan hidrojen sayısı kadar diğer tarafa H2O molekülü eklenir. Tekrar oksijen, hidrojen eşitliğini sağlamak için eklenen su molekül kadar diğer tarafa OH- eklenir.
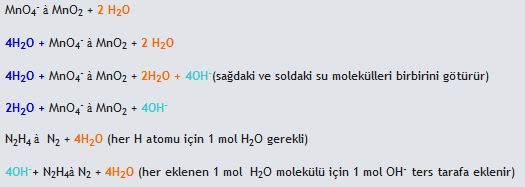
3. Herbir ara reaksiyondaki, reaksiyonun sağında ve solundaki yükü eşitlemek için gerekli tarafa elektron eklenir.
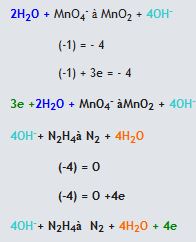
4. İki yarı tepkimenin elektronlarını aynı yapıp yok edebilmek için gerekli katsayı ile çarpılır ve yarı tepkimelere taraf tarafa toplanır